
【題目】今有Na2CO3、NaHCO3、NaCl組成的混合物100g,加熱到質量不再減少為止。剩余殘渣為84.5g,將殘渣溶于水,滴入足量的AgNO3溶液得到白色沉淀,加足量的稀硝酸后大部分沉淀消失,剩余沉淀為12.26g,試計算混合物中Na2CO3、NaHCO3和NaCl的質量分數各是多少?
【答案】解答:設NaHCO3的質量為x,NaCl的質量為y
2NaHCO3 ![]() Na2CO3+CO2↑+H2O Δm
Na2CO3+CO2↑+H2O Δm
168 62
x 100g-84.5g
列比例式 ![]() 解之,x=42g
解之,x=42g
NaCl+AgNO3====AgCl↓+NaNO3
58.5 143.5
y 12.26g![]() 解之,y=5g
解之,y=5g
m(Na2CO3)=100g-42g-5g=53g
由于混合物的總質量為100g,故混合物中Na2CO3、NaHCO3和NaCl的質量分數分別為53%、42%、5%。
【解析】設法求出100g混合物中各物質的質量,即可求出成分的質量分數。加熱到質量不再減少為止,減少的質量為2NaHCO3 ![]() Na2CO3+CO2↑+H2O 生成的CO2和H2O的質量,可根據方程式求出NaHCO3的質量。根據題意知12.26g沉淀為AgCl,可方程式NaCl+AgNO3====AgCl↓+NaNO3求出NaCl的質量。NaHCO3和NaCl的質量求出后,原混合物中Na2CO3的質量也就可求出了。
Na2CO3+CO2↑+H2O 生成的CO2和H2O的質量,可根據方程式求出NaHCO3的質量。根據題意知12.26g沉淀為AgCl,可方程式NaCl+AgNO3====AgCl↓+NaNO3求出NaCl的質量。NaHCO3和NaCl的質量求出后,原混合物中Na2CO3的質量也就可求出了。


科目:高中化學 來源: 題型:
【題目】一定條件下,可逆反應X(g)+3Y(g)2Z(g),若X、Y、Z起始濃度分別為c1、c2、c3(均不為0),平衡時X、Y、Z的濃度分別為0.1molL﹣1、0.3molL﹣1、0.08molL﹣1 , 則下列判斷正確的是( )
A.c1:c2的值不能確定
B.平衡時,Y和Z的生成速率之比為1:1
C.0.48molL﹣1<c1+c2+c3<0.56molL﹣1
D.c1的取值范圍為0<c1<0.14 molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵電池是一種新型可充電電池,與普通電池相比,該電池能較長時間保持穩定的放電電壓.高鐵電池的總反應為:請回答下列問題:
3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.
3Zn(OH)2+2Fe(OH)3+4KOH.
(1)高鐵電池的負極材料是 .
(2)放電時,正極發生(填“氧化”或“還原”)反應;已知負極反應為Zn﹣2e﹣+2OH﹣═Zn(OH)2 , 則正極反應為 .
(3)放電時,(填“正”或“負”)極附近溶液的堿性增強.
(4)充電時,陰極的電極反應式為 .
(5)充電時,理論上分析,每生成0.15moLK2FeO4轉移電子數為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上將相同物質的量的NaCl、CO2、NH3在30℃時配成溶液,此時溶液中無晶體。當降溫至某溫度時,開始析出晶體,此晶體是( )
A.NH4Cl
B.NH4HCO3
C.NaHCO3
D.NaCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列短周期元素性質的數據:下列關于表中11種元素的說法正確的是( )
元素 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
原子半徑(10﹣10m) | ﹣ | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
最高或最 | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
﹣2 | ﹣3 | ﹣4 | ﹣1 | ﹣3 |
A.上表中11種元素中形成的非金屬單質都有非極性共價鍵
B.②⑨處于同一周期,④⑧處于同一主族
C.上表中11種元素中最高價氧化物對應的水化物中⑦號酸性最強
D.⑥原子結構示意圖為 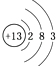
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗能達到目的的是
A. 只滴加氨水鑒別AlCl3、MgCl2溶液
B. 將NH4Cl溶液蒸干制備NH4Cl固體
C. 用萃取分液的方法除去酒精中的水
D. 用可見光束照射以區別溶液和膠體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中含有較大量的Cl-、CO32-、OH-3種陰離子,如果只取一次該溶液就能分別將3種陰離子依次檢驗出來,下列實驗操作順序(滴加的試劑均過量)正確的是( )
①滴加Mg(NO3)2溶液; ②過濾; ③滴加AgNO3溶液; ④滴加Ba(NO3)2溶液
A.①②④②③B.①②③②④C.④②①②③D.④②③②①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸工業在國民經濟中占有極其重要的地位。
(1)硫酸的最大消費渠道是化肥工業,用硫酸制造的常見化肥有(任寫一種)。
(2)硫酸生產中,根據化學平衡原理來確定的條件或措施有________(填寫序號)。
A.礦石加入沸騰爐之前先粉碎
B.使用V2O5作催化劑
C.轉化器中使用適宜的溫度
D.凈化后的爐氣中要有過量的空氣
E.催化氧化在常壓下進行
F.吸收塔中用98.3%的濃硫酸吸收SO3
(3)在硫酸工業中,通過下列反應使二氧化硫轉化為三氧化硫:2SO2(g)+ ![]() O2(g)
O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1。在實際工業生產中,常采用“二轉二吸法”,即將第一次轉化生成的SO3分離后,將未轉化的SO2進行二次轉化,假若兩次SO2的轉化率均為95%,則最終SO2的轉化率為。
2SO3(g) ΔH=-98.3 kJ·mol-1。在實際工業生產中,常采用“二轉二吸法”,即將第一次轉化生成的SO3分離后,將未轉化的SO2進行二次轉化,假若兩次SO2的轉化率均為95%,則最終SO2的轉化率為。
(4)硫酸的工業制法過程涉及三個主要的化學反應及相應的設備(沸騰爐、轉化器、吸收塔)。
①三個設備分別使反應物之間或冷熱氣體之間進行“對流”。請簡單描述吸收塔中反應物之間是怎樣對流的。。
②工業生產中常用氨-酸法進行尾氣脫硫,以達到消除污染、廢物利用的目的。用化學方程式表示其反應原理。(只寫出2個方程式即可).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com