
 已知:①圖中每個小三角形的三種物質中至少含有一種相同元素,H與I含有完全相同的元素.②A、J為固體單質,D為氣體單質,其余物質為常見化合物.③B為淡黃色化合物,B與H反應能生成D.④E為常見金屬氧化物.⑤F的溶液和H反應生成白色膠狀沉淀G.
已知:①圖中每個小三角形的三種物質中至少含有一種相同元素,H與I含有完全相同的元素.②A、J為固體單質,D為氣體單質,其余物質為常見化合物.③B為淡黃色化合物,B與H反應能生成D.④E為常見金屬氧化物.⑤F的溶液和H反應生成白色膠狀沉淀G. .
.分析 B為淡黃色化合物,B與H反應能生成D,且D為氣體單質,則B為Na2O2,D為O2,H為H2O或CO2;A為固體單質,A能夠發生反應生成Na2O2,則A為金屬Na;Na和過氧化鈉都能夠轉化成C,則C為NaOH;J為固體單質,J能夠轉化成H,則J為C,又H與I含有完全相同的元素,則H為CO2,I為CO;E為常見金屬氧化物、⑤F的溶液和H反應生成白色膠狀沉淀G,則F為NaAlO2,G為Al(OH)3,E為Al2O3,電解融融的E(Al2O3)可得鋁和氧氣,據此進行解答.
解答 解:B為淡黃色化合物,B與H反應能生成D,且D為氣體單質,則B為Na2O2,D為O2,H為H2O或CO2;A為固體單質,A能夠發生反應生成Na2O2,則A為金屬Na;Na和過氧化鈉都能夠轉化成C,則C為NaOH;J為固體單質,J能夠轉化成H,則J為C,又H與I含有完全相同的元素,則H為CO2,I為CO;E為常見金屬氧化物、⑤F的溶液和H反應生成白色膠狀沉淀G,則F為NaAlO2,G為Al(OH)3,E為Al2O3,電解融融的E(Al2O3)可得鋁和氧氣,
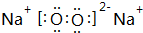
(1)B為Na2O2,過氧化鈉為離子化合物,其電子式為 ,
,
故答案為: ;
;
(2)B為過氧化鈉,H為二氧化碳,過氧化鈉與二氧化碳反應生成碳酸鈉和氧氣,反應的化學方程式為:2Na2O2+2CO2=2Na2CO3+O2,
故答案為:2Na2O2+2CO2=2Na2CO3+O2;
(3)向偏鋁酸鈉的水溶液中通入少量二氧化碳生成氫氧化鋁沉淀和碳酸鈉,反應的離子方程式為:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案為:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)E為氧化鋁,電解融融的氧化鋁可以獲得鋁和氧氣,反應的化學方程式為:2Al2O3(融融)$\frac{\underline{\;電解\;}}{\;}$4Al+3O2↑;100g氧氣的物質的量為:$\frac{100g}{32g/mol}$=3.125mol,根據電子守恒,生成3.125mol氧氣轉移的電子的物質的量為:3.125mol×4=12.5mol,所以轉移的電子數為12.5NA,
故答案為:2Al2O3(融融)$\frac{\underline{\;電解\;}}{\;}$4Al+3O2↑;12.5NA;
(5)若測得1g固體單質J與一定量的氣體H恰好完全反應生成氣態I時吸收的熱量為Q kJ,J為C,H為二氧化碳,I為CO,1g C的物質的量為:$\frac{1g}{12g/mol}$=$\frac{1}{12}$mol,則1molC完全反應吸收的熱量為12QkJ,故該反應的熱化學方程式為:C(s)+CO2(g)═2CO(g)△H=+12Q kJ•mol-1,
故答案為:C(s)+CO2(g)═2CO(g)△H=+12Q kJ•mol-1.
點評 本題考查無機物的推斷,題目難度中等,“B為淡黃色固體、A、J為固體單質,D為氣體單質”等為解答本題的突破口,熟悉物質的性質及相互轉化推斷物質為解答本題的關鍵,側重Na、C、Al元素單質及其化合物性質的考查,試題充分培養了學生的分析、理解能力及邏輯推理能力.


科目:高中化學 來源: 題型:解答題
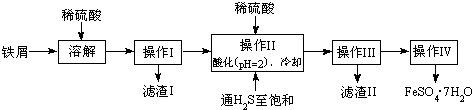
| 25℃時 | pH值 |
| 飽和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS開始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中只存在離子鍵 | |
| B. | 非金屬元素組成的化合物中可能存在離子鍵 | |
| C. | 由不同種元素組成的多原子分子里,一定只存在極性共價鍵 | |
| D. | 含金屬元素的化合物中一定存在離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 醋酸濃度/mol•L-1 | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18.4mol | B. | 18.4mol•L-1 | C. | 20.4 | D. | 20.4mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 一定質量的鎂、鋁混合物投入2mol•L-1的鹽酸中,待金屬完全溶解后,向溶液中加入2mol•L-1的氫氧化鈉溶液,生成沉淀的質量與加入氫氧化鈉溶液的體積關系如圖所示.則n(Mg)/n(Al)的最大值是( )
一定質量的鎂、鋁混合物投入2mol•L-1的鹽酸中,待金屬完全溶解后,向溶液中加入2mol•L-1的氫氧化鈉溶液,生成沉淀的質量與加入氫氧化鈉溶液的體積關系如圖所示.則n(Mg)/n(Al)的最大值是( )| A. | 1:1 | B. | 8:1 | C. | 4:1 | D. | 5:2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com