
【題目】寫出下列有機物的類別及所含官能團的名稱。
(1)CH3CH=CH2____、_________;
(2)HC≡C—CH2CH3__________、__________;
(3)![]() _________、___________;
_________、___________;
(4)![]() _________、_________;
_________、_________;
(5)![]() _________、___________;
_________、___________;
(6)CH3CH2—O—CH3__________、__________。
科目:高中化學 來源: 題型:
【題目】下列有關中和熱概念、中和熱測定實驗(如圖)的說法正確的是
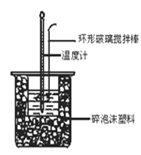
A.已知在稀溶液中:H+(aq)+OH-(aq) =H2O(l);ΔH=-57.3kJ·mol-1,則有![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
B.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6kJ·mol-1,則該反應的中和熱為114.6 kJ·mol-1。
C.中和熱測定實驗過程中,環形玻璃攪拌棒材料若用銅代替,則測量出的中和熱數值偏小
D.酸堿混合時,量筒中的NaOH溶液應分多次倒入已裝有鹽酸的小燒杯中,并不斷用環形玻璃攪拌棒攪拌。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列敘述不正確的是( )
A.60gSiO2晶體含4NA個σ鍵
B.78gNa2O2晶體中含有離子個數為4NA
C.在12g石墨中含CC共價鍵數目為1.5NA
D.CO和N2是等電子體,標況下22.4L的CO氣體與1molN2所含的電子數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,其中所列數字分別代表某一元素。

請你根據表中所給元素,回答下列問題:
(1)表中屬于d區的元素是_________(填編號)。
(2)⑤⑥⑦三種元素中電負性最大的是_____(填寫元素符號),在第二周期中第一電離能介于②和③之間的元素有_______種;
(3)元素⑨在周期表中的位置_______________。
(4)元素⑧和⑦能形成一種常見的干燥劑,它的電子式為_____________。
(5)寫出下列有關反應的離子方程式:⑩的單質與元素③的最高價氧化物,對應的水化物的稀溶液反應:___________________________。
(6)⑥和⑦相比較,非金屬性較弱的是______(填元素符號),可以驗證你的結論的是下列中的_____(填編號)。
a.氣態氫化物的穩定性; b.兩元素的電負性;c.含氧酸的酸性; d. 最高化合價
(7)①與③的元素形成的10電子中性分子X的空間構型為_____,它極易溶于水中,請簡要說明該物質易溶于水的原因_______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種晶體的晶胞結構如圖所示,下列有關說法正確的是( )
A.圖甲所示晶體的化學式為A3B4C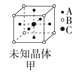
B.圖乙所示晶體中陰陽離子個數比為1:1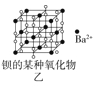
C.圖丙所示CaF2晶體中Ca2+配位數為4,F-配位數為8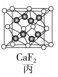
D.圖丁所示晶體屬于簡單立方堆積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)X射線衍射測定等發現,I3AsF6中存在I3+離子。I3+離子的幾何構型為_____,中心原子的雜化類型為_____。
(2)CS2分子中,C原子的雜化軌道類型是_____。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子構型為_____,其中氧原子的雜化方式為_____。
(4)CH3COOH中C原子軌道雜化類型為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鉬在工業和國防建設中有重要的作用。鉬(Mo)的常見化合價為+6、+5、+4。由鉬精礦(主要成分是MoS2)可制備單質鉬和鉬酸鈉晶體(Na2MoO4·2H2O),部分流程如圖1所示:
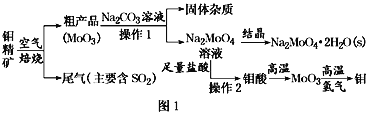
已知:鉬酸微溶于水,可溶于液堿和氨水。
回答下列問題:
(1)焙燒鉬精礦時發生的化學方程式為_____________________________。
(2)鉬精礦焙燒時排放的尾氣對環境的主要危害是___________________,請提出一種實驗室除去該尾氣的方法____________________________________。
(3)操作2的名稱為________。由鉬酸得到MoO3所用到的硅酸鹽材料儀器的名稱是________。
(4)焙燒鉬精礦所用的裝置是多層焙燒爐,圖2為各爐層固體物料的物質的量的百分數(φ)。
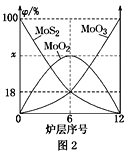
①x=________。
②焙燒爐中也會發生MoS2與MoO3反應生成MoO2和SO2的反應,若該反應轉移6mol電子,則消耗的氧化劑的化學式及物質的量分別為________、________。
(5)操作1中,加入碳酸鈉溶液充分反應后,堿浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在結晶前需加入Ba(OH)2固體以除去溶液中的SO42-。當BaMoO4開始沉淀時,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液體積變化可忽略不計]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)工業上常用蘇打燒結法提取自然界中的稀散元素硒(Se),我國科研人員自主設計的利用粗銅電解精煉所產生含硒化亞銅(Cu2Se)和碲化亞銅(Cu2Te)的陽極泥為原料,提取硒的某種工藝流程如圖所示。

回答下列問題:
(1)電解精煉銅時,電源的正極連接_______(填“粗銅”或“精銅”),陽極溶解銅的質量__________(填“>”“=”或“<”)陰極析出銅的質量。
(2)“燒結”時蘇打和硒化亞銅主要生成了Na2SeO3、Cu2O和CO2氣體,該反應的化學方程式為________________________________。“燒結”時生成了少部分Na2SeO4,寫出“還原”時反應的離子方程式____________。
(3)含硒燒結物浸取時,最佳加熱方式為________________,除去的物質為___________(填化學式)。
(4)本工藝副產物TeO2用于制造紅外器件、聲光器件材料,可溶于強酸和強堿,并形成復鹽,則TeO2屬于______氧化物(填“酸性”“堿性”或“兩性”)。
(5)把硫酸工業第一步的產物SO2通入Na2SeO3溶液制備硒單質,寫出該反應的離子方程式_____________。若得到50 kg硒單質,至少需要___________kg質量分數為90%的FeS2礦石。(結果保留一位小數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將1.000mol/L鹽酸滴入20.00mL1.000mol/L氨水中,溶液pH和溫度隨加入鹽酸體積變化曲線如圖所示。下列有關說法正確的是( )
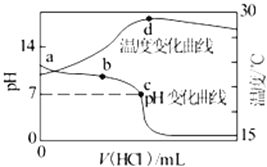
A.a點由水電離出的c(H+)=1.0×10-14mol/L
B.b點時c(NH4+)+c(NH3·H2O)>c(Cl-)
C.c點時消耗的鹽酸體積:V(HCl)=20.00mL
D.d點后,溶液溫度略下降的主要原因是NH3·H2O電離吸熱
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com