
| 實 驗 事 實 | 結 論 | |
| ① | 在相同溫度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,產生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成紅褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 將CO2通入到Na2SiO3溶液中產生白色渾濁 | 酸性:H2CO3>H2SiO3 |
| ③ | 在鎂鋁為電極,氫氧化鈉為電解質的原電池裝置中,鎂表面有氣泡 | 金屬活動性:Al>Mg |
| ④ | 已知反應5Cl2+I2+6H2O═2HIO3+10HCl, 2BrO3-+Cl2═2ClO3-+Br2 | 氧化性強弱順序:BrO3->Cl2>ClO3->IO3- |
| ⑤ | 測定等物質的量濃度的Na2SO4與Na2CO3溶液的pH,后者較大 | 非金屬性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
分析 ①氫氧化鈉過量,不能證明溶解度大小;
②CO2通入到Na2SiO3溶液中產生H2SiO3,反應進行屬于復分解反應,符合強酸制備弱酸;
③鎂、鋁為電極,氫氧化鈉為電解質的原電池裝置中,Al為負極;
④氧化還原反應中含有元素化合價降低的物質為氧化劑,通過氧化反應得到的產物為氧化產物,根據氧化還原反應中氧化劑的氧化性強于氧化產物的氧化性來解答;
⑤元素的最高價氧化物的水化物酸性越強,其非金屬性越強.
解答 解:①氧化鈉過量,不能證明溶解度大小,如加入足量氯化鎂完全生成氫氧化鎂沉淀后再加入氯化鐵,能生成紅褐色沉淀,則可證明,故①錯誤;
②CO2通入到Na2SiO3溶液中產生H2SiO3,實際是碳酸與碳酸鈉發生反應,反應進行屬于復分解反應,符合強酸制備弱酸,故②正確;
③鎂、鋁為電極,氫氧化鈉為電解質的原電池裝置中,Al為負極,Mg為正極,氫離子在Mg電極上得到電子生成氫氣,但金屬性Mg>Al,Mg與NaOH不反應,故③錯誤;
④5Cl2+I2+6H2O═2HIO3+10HCl,氧化劑為Cl2,氧化產物為IO3-,所以氧化性Cl2>IO3-;
2BrO3-+Cl2═2ClO3-+Br2,氧化劑為BrO3-,氧化產物為ClO3-,所以氧化性BrO3->ClO3-;
所以得不到氧化性BrO3->Cl2.故④錯誤;
⑤測定等物質的量濃度的Na2SO4與Na2CO3溶液的pH,后者較大,說明酸性:Na2SO4>Na2CO3,所以得非金屬性S>C,故⑤正確;
故選B.
點評 本題考查較為綜合,涉及沉淀轉化、酸性、金屬活動性、氧化性、非金屬性比較等知識,側重于學生的分析能力、實驗能力和評價能力的考查,為高考常見題型,注意把握實驗的角度和原理,難度不大.


 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
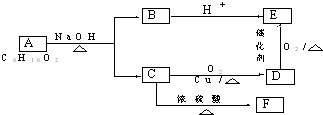
 .
.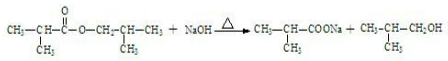 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
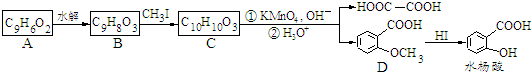
 .
.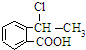 合成
合成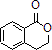 ,寫出相關化學反應方程式
,寫出相關化學反應方程式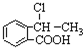 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +H2O+NaCl、
+H2O+NaCl、 +HBr$\stackrel{過氧化物}{→}$
+HBr$\stackrel{過氧化物}{→}$ 、
、 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$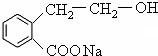 ++NaBr+H2O、2
++NaBr+H2O、2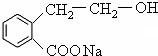 +H2SO4$\stackrel{△}{→}$2
+H2SO4$\stackrel{△}{→}$2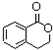 +2H2O+Na2SO4.
+2H2O+Na2SO4.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

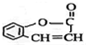
 .
.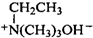 $\stackrel{△}{→}$CH2=CH2;請寫出以
$\stackrel{△}{→}$CH2=CH2;請寫出以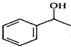 、HCHO、HN(CH3)2為有機原料,合成
、HCHO、HN(CH3)2為有機原料,合成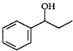 的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵在常溫下不溶于濃硝酸,說明鐵與濃硝酸不反應 | |
| B. | 將氯氣溶于水后溶液呈淺黃綠色,說明氯氣與水沒有完全反應 | |
| C. | 將某氣體通入品紅溶液中溶液褪色,說明該氣體一定是二氧化硫 | |
| D. | 向溶液中滴加鹽酸酸化的BaCl2溶液出現白色沉淀,說明該溶液中一定有SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗方案 | 現象 | 結論 |
| A | 將水垢置于盛食醋的試管中 | 有氣泡產生 | 醋酸的酸性比碳酸強 |
| B | 用濕潤的藍色試紙檢驗某氣體 | 試紙變紅 | 氣體是酸性氧化物 |
| C | 向飽和Na2CO3溶液中通入CO2 | 有晶體析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液變紅 | Na2O2是堿性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com