
分析 (1)氯元素化合價變化的做還原劑,氯元素化合價不變的做酸,濃鹽酸在此反應中顯示出來的性質是還原性和酸性;
(2)氯氣易溶于水,在飽和氯化鈉溶液中溶解度較小;
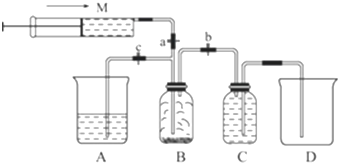
(3)由題意可知用儀器A吸收過量的氯氣,氯氣與氫氧化鈉反應生成氯化鈉、次氯酸鈉和水;
(4)若用含1.6mol氯化氫的濃鹽酸與足量的高錳酸鉀反應,2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O,在標準狀況下收集到的氯氣體積應為0.5mol,標準狀況體積為22.4L/mol×0.5mol=11.2L,但足量高錳酸鉀反應,隨反應進行,濃鹽酸濃度減小,變為稀鹽酸后不能繼續生成氯氣.
解答 解:(1)反應的化學方程式為2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O,氯元素化合價變化的做還原劑,氯元素化合價不變的做酸,濃鹽酸在此反應中顯示出來的性質是還原性和酸性,
故答案為:B;
(2)氯氣易溶于水,在飽和氯化鈉溶液中溶解度較小,所以可以用排飽和食鹽水的方法收集氯氣,裝置C中為飽和食鹽水,
故答案為:飽和NaCl溶液;
(3)由題意可知用儀器A吸收過量的氯氣,要想使反應剩余氣體進入A,應關閉彈簧夾a和彈簧夾b,打開彈簧夾c,氯氣與氫氧化鈉溶液反應的化學方程式為:2NaOH+Cl2═NaCl+NaClO+H2O,反應的離子方程式為:2OH-+Cl2═Cl-+ClO-+H2O,
故答案為:b,c;2OH-+Cl2═Cl-+ClO-+H2O;
(4)若用含1.6mol氯化氫的濃鹽酸與足量的高錳酸鉀反應,2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O,在標準狀況下收集到的氯氣體積應為0.5mol,標準狀況體積為22.4L/mol×0.5mol=11.2L,但足量高錳酸鉀反應,隨反應進行,濃鹽酸濃度減小,變為稀鹽酸后不能繼續生成氯氣,所以在標準狀況下收集到的氯氣體積<11.2L,
故答案為:C.
點評 本題考查了氯氣的制法和有關氧化還原的計算,題目難度中等,熟悉物質的性質和制備原理,明確氧化還原反應的規律是解題關鍵,注意反應中鹽酸既表現還原性又表現酸性.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 碘酸鉀 | B. | 碘化鉀 | C. | 碘單質 | D. | 絡合碘 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碰撞理論認為,反應物分子間必須相互碰撞才有可能發生反應,反應速率的大小與單位時間內反應物分子間有效碰撞的次數成正比 | |
| B. | 電解原理在生產中有著廣泛的應用,工業上用電解熔融的氯化鈉、氯化鎂、氯化鋁來冶煉Na、Mg、Al等活潑金屬單質 | |
| C. | 蓋斯定律表明,一個化學反應的焓變(△H)不僅與反應的起始和最終狀態有關,還與反應的途徑及過程有關 | |
| D. | 在工業生產中,研制出性能優良的催化劑可以使反應的溫度降低,有效提高反應物的轉化率,從而起到很好的節能效果 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗編號 | 合金質量(mg) | NO體積(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
| A. | 硝酸的濃度為4.0mol•L-1 | B. | 硝酸的濃度為1.0mol•L-1 | ||
| C. | 至少需要NaOH溶液的體積為75mL | D. | 至少需要NaOH溶液的體積為85mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com