
【題目】消毒劑在生產(chǎn)生活中有極其重要的作用,開發(fā)具有廣普、高效、低毒的殺菌劑和消毒劑是今后發(fā)展的趨勢。
Ⅰ.含氯消毒劑在生產(chǎn)生活中有極其重要的作用。
(1)Cl2常用于自來水的殺菌消毒。Cl2溶于水后,溶液中具有氧化作用的含氯微粒除Cl2外還有______________。
(2)為了提高生活用水的衛(wèi)生標準,自來水廠常同時使用Cl2和FeSO4·7H2O進行消毒、凈化,以改善水質(zhì)。其原因:一是_________________________________ (用離子方程式和相應的文字解釋),二是生成的Fe(OH)3膠體具有較強的吸附 性能,可吸附水中的懸浮雜質(zhì),并能形成沉淀,使水凈化。
(3)KClO3和濃鹽酸在一定溫度下反應,還原產(chǎn)物為黃綠色的易爆物二氧化氯。常用作消毒劑,其變化可以表示為:2KClO3+4HCl(濃) = 2KCl+2ClO2↑+Cl2↑+2H2O,若改變溫度至70 ℃,發(fā)現(xiàn)KClO3和濃鹽酸反應的氧化產(chǎn)物和還原產(chǎn)物均為二氧化氯氣體,試寫出反應的化學方程式:_______________________。
Ⅱ.鐵的化合物高鐵酸鈉(Na2FeO4)是一種新型凈水劑。
(1)高鐵酸鈉主要通過反應制取:2Fe(OH)3+3X+ 4NaOH=2Na2FeO4+3NaCl+ 5H2O,則X的化學式為_____________。
(2)高鐵酸鈉在水中可以發(fā)生反應:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-↑+3O2。由此看來,高鐵酸鈉能夠殺菌消毒是因為它具有________性。
4Fe(OH)3+8OH-↑+3O2。由此看來,高鐵酸鈉能夠殺菌消毒是因為它具有________性。
Ⅲ.(1)H2O2可作為礦業(yè)廢液消毒劑,有“綠色氧化劑”的美稱。H2O2被稱為“綠色氧化劑”的理由是________________________________。
(2)取一定量的酸性KMnO4溶液依次進行下列實驗,有關(guān)現(xiàn)象記錄如下:
①加適量H2O2,紫紅色褪去,并有氣泡產(chǎn)生;
②加入適量的PbO2固體,固體溶解,溶液又變?yōu)樽霞t色;
③后通入足量SO2,發(fā)生反應:5SO2+2MnO4-+5Pb2++2H2O==5PbSO4↓+2Mn2++4H+。
則KMnO4、H2O2、PbO2氧化性由強到弱的順序為_______________________。
【答案】HClO和ClO- Cl2+2Fe2+===2Cl-+2Fe3+ 能消耗多余的Cl2 5KClO3+6HCl(濃) === 5KCl+6ClO2↑+3H2O NaClO 氧化性 H2O2是氧化劑時其還原產(chǎn)物是H2O,沒有污染 PbO2>KMnO4>H2O2
【解析】
Ⅰ.(1)根據(jù)Cl2溶解在水里和與水反應的產(chǎn)物性質(zhì)進行解答;
(2)從反應要消耗Cl2及Cl2的毒性來分析解答;
(3)由題意寫出參加氧化還原反應的物質(zhì),再由原子守恒寫出其他化學式并配平方程式;
Ⅱ.(1)根據(jù)原子守恒來解答;
(2)由已知反應考慮高鐵酸鈉的化學性質(zhì);
Ⅲ.(1)由雙氧水發(fā)生還原反應后的生成物來考慮;
(2)根據(jù)氧化還原反應里氧化劑、氧化產(chǎn)物的氧化性強弱規(guī)律進行解答。
Ⅰ.(1)Cl2與水反應:Cl2+H2O=HCl+HClO,生成的HClO是一種弱酸,能電離出少部分ClO-,HClO 、ClO-都具有強氧化性。
答案為:HClO和ClO-;
(2)Cl2有毒性,可以用來消毒,但殘留在水中會影響水質(zhì),利用Cl2和FeSO4·7H2O發(fā)生反應;Cl2+2Fe2+===2Cl-+2Fe3+ 可以去除殘留的Cl2。
答案為:Cl2+2Fe2+===2Cl-+2Fe3+ 能消耗多余的Cl2;
(3)KClO3和濃鹽酸反應的氧化產(chǎn)物和還原產(chǎn)物均為二氧化氯氣體,反應中KClO3中的Cl由+5價降為+4價,鹽酸中的Cl由-1價升為+4價,再根據(jù)反應前后原子守恒確定其他生成物,最后配平,反應的化學方程式為;5KClO3+6HCl(濃) === 5KCl+6ClO2↑+3H2O。
答案為:5KClO3+6HCl(濃) === 5KCl+6ClO2↑+3H2O。
Ⅱ.(1)由反應2Fe(OH)3+3X+ 4NaOH=2Na2FeO4+3NaCl+ 5H2O前后各元素的原子個數(shù)不變可知X化學式為NaClO;
答案為:NaClO;
(2)4FeO42-+10H2O![]() 4Fe(OH)3+8OH-↑+3O2這個反應中FeO42-表現(xiàn)出很強的氧化性,而高鐵酸鈉能夠消毒殺菌就是因為它的強氧化性;
4Fe(OH)3+8OH-↑+3O2這個反應中FeO42-表現(xiàn)出很強的氧化性,而高鐵酸鈉能夠消毒殺菌就是因為它的強氧化性;
答案為:氧化性;
Ⅲ.(1)雙氧水H2O2作氧化劑發(fā)生還原反應,得到的還原產(chǎn)物是H2O,對環(huán)境沒有污染,被稱為“綠色氧化劑”;
答案為:H2O2是氧化劑時其還原產(chǎn)物是H2O,沒有污染;
(2)實驗①說明H2O2能被KMnO4氧化,所以氧化性:KMnO4> H2O2,實驗②說明Mn2+能與PbO2反應生成KMnO4,得出氧化性:PbO2>KMnO4,則KMnO4、H2O2、PbO2氧化性由強到弱的順序為PbO2>KMnO4>H2O2;
答案為:PbO2>KMnO4>H2O2;


科目:高中化學 來源: 題型:
【題目】在銀鋅原電池中,以硫酸銅為電解質(zhì)溶液,鋅為_____極,電極上發(fā)生的是_____反應(“氧化”或“還原”).電極反應式為_____,鋅片上觀察到的現(xiàn)象為_____銀為_____極,電極上發(fā)生的是_____反應(“氧化”或“還原”),電極反應式是_____,銀片上觀察到的現(xiàn)象是_____.

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中,將10mol CO和一定量的H2S混合加熱并達到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物質(zhì)的量為8mol。下列說法正確的是( )
COS(g)+H2(g) K=1,平衡后CO物質(zhì)的量為8mol。下列說法正確的是( )
A.CO、H2S的轉(zhuǎn)化率之比為1∶1
B.達平衡后H2S的體積分數(shù)為4%
C.升高溫度,COS濃度減小,表明該反應是吸熱反應
D.恒溫下向平衡體系中再加入CO、H2S、COS、H2各1mol,平衡不移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】膽礬(CuSO45H2O)高溫時發(fā)生反應:2CuSO45H2O![]() 2CuO + 2SO2↑+ O2↑+ 10H2O。下列裝置能達到實驗目的的是( )
2CuO + 2SO2↑+ O2↑+ 10H2O。下列裝置能達到實驗目的的是( )
A.可用于膽礬分解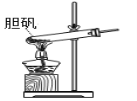
B.可用于檢驗產(chǎn)物是否含H2O 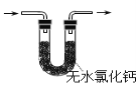
C.可用于收集O2 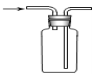
D.可用于吸收膽礬分解的SO2 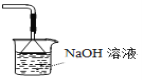
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素X、Y、Z、W原子序數(shù)依次增大,其中Y是構(gòu)成物質(zhì)種類最多的一種元素。m、n、p均為由這些元素組成的二元化合物,甲、乙、丙是其中三種元素對應的單質(zhì),m的自述是“誕生在閃電的弧光中,強大的能量造就了我”。n能使?jié)駶櫟募t色石蕊試紙變藍。上述物質(zhì)的轉(zhuǎn)化關(guān)系如圖所示(反應條件已略去)。下列說法正確的是

A. 常溫常壓下,X與Y組成的化合物一定為氣體
B. X、Z、W三種元素不能組成離子化合物
C. 原子半徑:X<W<Y<Z
D. 圖示轉(zhuǎn)化關(guān)系中涉及的反應均為氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗中,所采取的分離方法與對應原理都正確的是( )
選項 | 實驗目的 | 分離方法 | 原理 |
A | 除去CO2中的HCl | 通入飽和Na2CO3溶液 | HCl和Na2CO3溶液反應生成CO2 |
B | 除去乙醇中少量的乙酸 | 加入足量生石灰蒸餾 | 乙醇和乙酸鈣的沸點相差較大 |
C | 除去KNO3固體中NaCl | 冷卻熱飽和溶液重結(jié)晶 | NaCl在水中的溶解度很大 |
D | 分離乙酸乙酯和乙醇 | 用分液漏斗分液 | 乙醇乙酯和乙醇的密度不同 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業(yè)上以鈦鐵礦[主要成分為鈦酸亞鐵( FeTiO3),含有MgO、SiO2等雜質(zhì)]為原料,制備金屬鈦和鐵紅的工藝流程如下:

已知:①酸浸時, FeTiO3轉(zhuǎn)化為Fe2+和TiO2+;②本實驗溫度下,Ksp[Mg(OH)2]=1.0×10-11;請回答下列問題:
(1)酸浸時如何提高浸取速度和浸取率_____________________________(至少答兩種方法)。
(2)“水解”生成H2TiO3的離子方程式為_________________________。
(3)“沉鐵”過程中,氣態(tài)產(chǎn)物的電子式為__________________;該過程需控制反應溫度低于35 ℃,原因為___________________________________________________。
(4)濾液3可用于制備Mg(OH)2。若濾液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固體,調(diào)整溶液pH值大于________時,可使Mg2+沉淀完全。
(5)“電解”時,電解質(zhì)為熔融的CaO,兩電極材料為石墨棒。則_______極石墨棒需要定期更換,原因是__________________________________________________________。
(6)測定鐵紅產(chǎn)品純度:稱取m g鐵紅,溶于一定量的硫酸之中,配成500.00 mL溶液。從其中量取20.00 mL溶液,加入過量的KI,充分反應后,用 c mol/L硫代硫酸鈉(Na2S2O3)標準液滴定至終點,發(fā)生反應:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸鈉平均消耗體積為V mL。則鐵紅產(chǎn)品的純度為________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸鈉平均消耗體積為V mL。則鐵紅產(chǎn)品的純度為________(用c、V、m表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組用廢舊鍍鋅鐵皮按下列流程制備七水硫酸鋅(ZnSO4·7H2O)

相關(guān)信息如下:
①金屬離子形成氫氧化物沉淀的pH,如圖A所示。
②ZnSO4的溶解度(物質(zhì)在100g水中溶解的質(zhì)量)隨溫度變化曲線如圖B所示。

請回答:
(1)為提高鍍鋅鐵皮中金屬離子的浸出率,除了可適當增加硫酸的濃度,還可以采取的措施有:_______(任寫一條)。
(2)步驟Ⅱ中需加入過量H2O2,請用離子方程式表示H2O2的作用________。
(3)步驟Ⅲ中調(diào)節(jié)pH范圍為_______,調(diào)節(jié)pH宜選用的試劑為_______。
A.稀硫酸 B.氫氧化鋅 C.氫氧化鈉 D.氧化鋅
(4)檢驗步驟Ⅲ所得濾液中是否含有Fe3+可采用的實驗方法是_______。
(5)步驟Ⅳ需要用到下列所有操作:a.蒸發(fā)至溶液出現(xiàn)晶膜 b.在60℃蒸發(fā)溶劑 c.冷卻至室溫 d.在100℃蒸發(fā)溶劑 e.過濾
請給出上述操作的正確順序______(操作可敢復使用)。
(6)步驟V中,某同學采用不同降溫方式進行冷卻結(jié)都,測得ZnSO4·7H2O顆粒大小分布如圖所示。根據(jù)該實驗結(jié)果,為了得到顆粒大小相對均的較大晶粒,宜選擇______方式進行冷卻結(jié)晶。
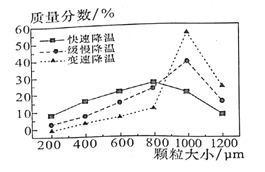
A.快速降溫 B.級慢降溫 C.變速降溫
(7)ZnSO4可用于制備金屬鋅。用鋅和高鐵酸鉀制成的高鐵堿性電池,能儲存比普通堿性電池多50%的電能,已知該電池的總反應是2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。該電池正極反應式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一種天然黃銅礦主要成分為CuFeS2 (含SiO2),為了測定該黃銅礦的純度,某同學設(shè)計了如圖1實驗:

稱取研細的黃銅礦樣品1.150g煅燒,生成Cu、Fe2O3 、FeO和SO2氣體,實驗后取d中溶液的1/5置于錐形瓶中,用0.01mo1/L標準碘溶液進行滴定,初讀數(shù)為0.10mL,末讀數(shù)如圖2所示.完成下列填空:
(1)裝置c的作用是____________________________。
(2)上述反應結(jié)束后,仍需通一段時間的空氣,其目的是_____________________。
(3)滴定時,標準碘溶液所耗體積為_____mL;用化學方程式表示滴定的原理:________________________________________。
(4)計算該黃銅礦的純度___________________。
(5)工業(yè)上利用黃銅礦冶煉銅產(chǎn)生的爐渣(含Fe2O3 、FeO、SiO2、Al2O3)可制備Fe2O3.
選用提供的試劑,設(shè)計實驗驗證爐渣中含有FeO.
提供的試劑:稀鹽酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所選試劑為_________;證明爐渣中含有FeO的實驗現(xiàn)象為:_________________。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com