
| A. | 在100℃、101 kPa條件下,液態水的氣化熱為40.69 kJ•mol-1,則H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,則所有含有固體MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||
| C. | 已知:
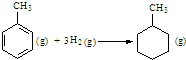 的△H為-384 kJ•mol-1 的△H為-384 kJ•mol-1 | |||||||||||
| D. | 常溫下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶體,能使NH3•H2O的電離度降低,溶液的pH減小 |
分析 A、從不同狀態的物質之間的轉化判斷,一般來說,氣體轉化為液體、液體轉化為固體放熱,反之吸熱;
B、在含有MgCO3固體的溶液中,Mg2+離子和CO32-離子不一定均來自于MgCO3,但溶度積常數只受溫度的影響;
C、苯環中不存在典型的碳碳雙鍵和碳碳單鍵,不能用表中數據進行計算;
D、NH3•H2O溶液中加入少量NH4Cl晶體,平衡向逆方向移動,電離程度降低.
解答 解:A、氣體轉化為液體是放熱過程,焓變為負值,則正確的表達為:H2O(g)?H2O(l)△H=-40.69kJ•mol-1,故A錯誤;
B、含有固體MgCO3的溶液中,Mg2+離子和CO32-離子不一定均來自于MgCO3,故Mg2+離子和CO32-離子的濃度不一定相等,但在相同的溫度下,溶度積常數不變,故B錯誤;
C、因為苯環中的碳碳鍵是介于單雙鍵之間的一種獨特的鍵,不存在典型的碳碳雙鍵和碳碳單鍵,不能用以上表中進行計算,故C錯誤;
D、NH3•H2O溶液中存在電離平衡,加入少量NH4Cl晶體,NH4+濃度增大使電離平衡向逆方向移動,電離程度降低,溶液的pH減小,故D正確.
故選D.
點評 本題考查反應熱、沉淀的溶解平衡、電離平衡等問題,本題易錯點為C項,注意苯的結構特點,題目難度中等.


科目:高中化學 來源: 題型:選擇題
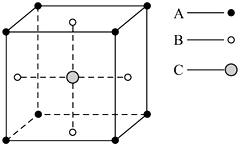
| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 顏色 | 白色 | 淺黃色 | 黃色 | 黑色 | 紅色 |
| Ksp | 2.0X10-10 | 5.4X10-13 | 8.3X10-17 | 2.0X10-41 | 2.0X10-12 |
| A. | 20℃時.AgCl飽和溶液和Ag2CrO4飽和溶液中.Ag+物質的量濃度由大到小的順序是Ag2CrO4>AgCl | |
| B. | 20℃時,向相同濃度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.會先生成淺黃色沉淀 | |
| C. | 20℃時,向相同濃度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,當兩種沉淀共存時.c(Br-):C(C1-)=2.7×10-3 | |
| D. | 在100ml AgCl、AgBr、AgI飽和的混合溶液中加入足量濃AgNO3溶液,產生沉淀AgI質量最多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 氬的原子序數 | B. | 氬原子的質量數 | ||
| C. | 氬元素的相對原子質量 | D. | 氬原子的相對原子質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
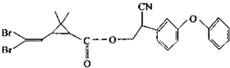 擬除蟲菊酯是一類高效、低毒、對昆蟲具有強烈觸殺作用的殺蟲劑,其中對光穩定的溴氰菊酯的結構簡式如圖,下列對該化合物敘述正確的是( )
擬除蟲菊酯是一類高效、低毒、對昆蟲具有強烈觸殺作用的殺蟲劑,其中對光穩定的溴氰菊酯的結構簡式如圖,下列對該化合物敘述正確的是( )| A. | 屬于芳香烴 | B. | 屬于有機化合物 | ||
| C. | 不能發生取代反應 | D. | 在一定條件下可以發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 左、下方區域的金屬元素 | |
| B. | 右、上方區域的非金屬元素 | |
| C. | 金屬元素與非金屬元素分界線附近的元素 | |
| D. | 過渡元素中 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
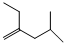
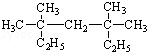 系統命名為3,3,5,5-四甲基庚烷
系統命名為3,3,5,5-四甲基庚烷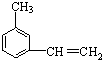
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
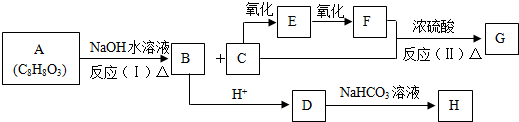
 ;B:
;B: ;E:HCHO G:HCOOCH3
;E:HCHO G:HCOOCH3 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 非金屬性比硫弱 | B. | 氫化物比HBr穩定 | ||
| C. | 原子序數為34 | D. | 最高價氧化物的水化物顯堿性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com