
【題目】釩(V)為過渡元素,可形成多價態化合物,全釩液流電池是一種新型的綠色環保儲能系統,工作原理如下圖:

已知:
離子種類 | VO2+ | VO2+ | V3+ | V2+ |
顏色 | 黃色 | 藍色 | 綠色 | 紫色 |
(1)全釩液流電池放電時V2+發生氧化反應,該電池放電時總反應式是_______
(2)當完成儲能時,正極溶液的顏色是 __________
(3)質子交換膜的作用是_________
(4)含釩廢水會造成水體污染,對含釩廢水(除VO2+外,還含Fe3+等)進行綜合處理可實現釩資源的回收利用,流程如下:

已知溶液酸堿性不同釩元素的存在形式不同:
釩的化合價 | 酸性 | 堿性 |
+4價 | VO2+ | VO(OH)3- |
+5價 | VO2+ | VO43- |
①濾液中釩元素的主要存在形式為_______
②濾渣在空氣中由灰白色轉變為紅褐色,用化學用語表示加入NaOH后生成沉淀的反應過程_______________、____________。
③萃取、反萃取可實現釩的分離和富集,過程可簡單表示為(HA為有機萃取劑):
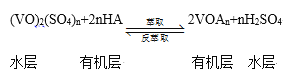
萃取時必須加入適量堿,其原因是 __________
④純釩可由熔鹽電解法精煉,粗釩(含雜質)作____極。
【答案】V2+ +VO2++2H+=V3++VO2++H2O 黃色 阻隔氧化劑與還原劑,使氫離子通過形成電流 VO(OH)3- Fe2+ + 2OH-=Fe(OH)2↓ 4Fe(OH)2+2H2O+O2=4Fe(OH)3 加入堿中和硫酸,促使平衡正向移動,提高釩的萃取率 陽極
【解析】
(1)B極是V2+失電子發生氧化反應生成V3+,A極VO2+得到電子發生還原反應生成VO2+,根據電極反應式書寫總反應式;
(2)儲能為充電過程,正極和外接電源正極相連,本身作陽極發生氧化反應,電極反應方程式為:VO2+- e-+H2O= VO2++2H+;
(3)質子交換膜的作用是阻隔氧化劑與還原劑,使氫離子通過形成電流;
(4)①由流程可知濾液為堿性且加入鐵粉后VO2+被還原為VO(OH)3-;
②Fe2+ + 2OH-=Fe(OH)2↓、4Fe(OH)2+2H2O+O2=4Fe(OH)3 。
③分析平衡,![]() ,加入堿中和硫酸,促使平衡正向移動,提高釩的萃取率;
,加入堿中和硫酸,促使平衡正向移動,提高釩的萃取率;
④電解法精煉釩,用粗釩作陽極,發生氧化反應。
(1)因為放電時,已知B極是V2+失電子發生氧化反應生成V3+,所以A極會得到電子發生還原反應,故電極反應方程式為:VO2++e-+2H+=VO2++H2O,故電池放電時總反應式是V2+ +VO2++2H+=V3++VO2++H2O,
故答案是:V2+ +VO2++2H+=V3++VO2++H2O;
(2)儲能為充電過程,正極和外接電源正極相連,本身作陽極發生氧化反應,電極反應方程式為:VO2+- e-+H2O= VO2++2H+,所以當完成儲能時,正極溶液的顏色是黃色;
故答案是:黃色;
(3)由電池放電時總反應式V2++VO2++2H+=V3++VO2++H2O可知,兩電極的物質混合會發生反應,故質子交換膜的作用是阻隔氧化劑與還原劑,使氫離子通過形成電流;
故答案是:阻隔氧化劑與還原劑,使氫離子通過形成電流;
(4)①根據表中信息,由流程可知濾液為堿性且加入鐵粉后VO2+被還原為VO(OH)3-,所以釩元素的主要存在形式為VO(OH)3-,
故答案是:VO(OH)3-;
②加入氫氧化鈉之后,由灰白色轉變為紅褐色,這是亞鐵離子轉化為鐵離子,反應過程為Fe2+ + 2OH-=Fe(OH)2↓、4Fe(OH)2+2H2O+O2=4Fe(OH)3。
故答案為:Fe2+ + 2OH-=Fe(OH)2↓; 4Fe(OH)2+2H2O+O2=4Fe(OH)3;
③分析平衡,![]() ,加入堿中和硫酸,促使平衡正向移動,提高釩的萃取率,
,加入堿中和硫酸,促使平衡正向移動,提高釩的萃取率,
故答案為:加入堿中和硫酸,促使平衡正向移動,提高釩的萃取率;
④電解法精煉釩,用粗釩作陽極,發生氧化反應,
故答案為:陽極。


科目:高中化學 來源: 題型:
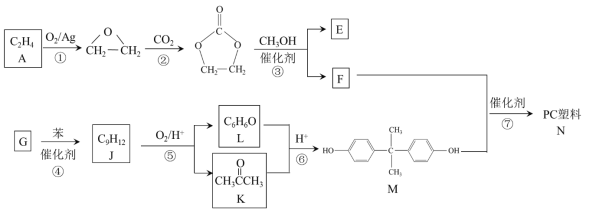
【題目】聚碳酸酯(簡稱PC)是重要的工程塑料,某種PC塑料(N)的合成路線如下:
已知:
i.R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
ii.R1CH=CHR2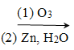 R1CHO + R2CHO
R1CHO + R2CHO
(1)A 中含有的官能團名稱是______。
(2)①、②的反應類型分別是______、______。
(3)③的化學方程式是______。
(4)④是加成反應,G的核磁共振氫譜有三種峰,G的結構簡式是______。
(5)⑥中還有可能生成的有機物是______(寫出一種結構簡式即可)。
(6)⑦的化學方程式是______。
(7)己二醛是合成其他有機物的原料。L經過兩步轉化,可以制備己二醛。合成路線如下:

中間產物1的結構簡式是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NF3是微電子工業中常用的一種等離子蝕刻氣體,具有較強的氧化性,工業生產NF3常用的方法有氣一液反應法、氣一固反應法和電解法等。
(1)氣一液反應法中發生的主反應和副反應包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____。部分鍵能數據如下表所示,△H3=_____kJ/mol。
化學鍵 | N-N | N=N | N | H-F | F-F | N-H | N-F |
鍵能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)氣一固反應法主要包括兩步反應:
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) 反應Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反應Ⅰ
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) 反應Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反應Ⅱ
反應I的平衡常數K1和反應II的平衡常數的關系是___。若在恒溫、恒容的密閉容器中模擬氣一固反應法(固體足量),起始時F2的濃度為5mol/L,反應過程中容器中壓強一隨時間變化曲線如圖所示,則前2min的平均反應速率v(NF3)=___mol/(Lmin),該溫度下K2=___。
(3)電解法是通過電解含氟的熔融鹽生產NF3,其原理如圖所示。a需要接電源的____(填“正極”或“負極”),生成氣體A的電極反應是____。
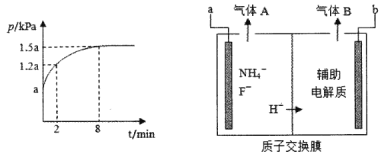
(4)用NF3對多晶硅電子元件進行蝕刻時不會在電子元件表面形成任何殘留物,其原因是_____。(用化學用語解釋)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2C2O4為二元弱酸,Ka1 (H2C2O4 ) =5.4×102,Ka2 (H2C2O4 ) =5.4×105,設H2C2O4溶液中c(總)=c(H2C2O4) +c(HC2O4) +c(C2O42)。室溫下用NaOH溶液滴定25.00 mL 0.1000 mol·L1H2C2O4溶液至終點。滴定過程得到的下列溶液中微粒的物質的量濃度關系一定正確的是
A. 0.1000 mol·L1 H2C2O4溶液:c(H+ ) =0.1000 mol·L1+c(C2O42 )+c(OH)c(H2C2O4 )
B. c(Na+ ) =c(總)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42 ) >c(H+ )
C. pH = 7的溶液:c(Na+ ) =0.1000 mol·L1+ c(C2O42) c(H2C2O4)
D. c(Na+ ) =2c(總)的溶液:c(OH) c(H+) = 2c(H2C2O4) +c(HC2O4)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解質水溶液中存在電離平衡、水解平衡、溶解平衡,請回答下列問題。
(1)已知部分弱酸的電離平衡常數如下表:
弱酸 | HCOOH | HCN | H2CO3 |
電離平衡常數(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3這4種溶液中陰離子結合質子能力最強的是__________________。
②體積相同、c(H+)相同的三種酸溶液①HCOOH;②HCN;③H2SO4分別與同濃度的NaOH溶液完全中和,消耗NaOH溶液的體積由大到小的排列順序是(填序號) _____________;
(2)一定濃度的NaCN溶液pH=9,用離子方程式表示呈堿性的原因是___________;此時c(HCN)/c(CN-)=______________。
(3)已知CaCO3的Ksp=2.8×l0-9,現將濃度為5.6×l0-4mol/LNa2CO3溶液與CaCl2溶液等體積混合,則生成CaCO3沉淀所需CaCl2溶液的最小濃度為__________ mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸亞鐵鋰(LiFePO4)電池是新能源汽車的動力電池之一。廢舊電池正極片(磷酸亞鐵鋰、炭黑和鋁箔等)可再生利用,其工藝流程如下:

已知:碳酸鋰在水中的溶解度,0℃時為1.54g,90℃時為0.85g,100℃時為0.71g。
(1)上述流程中至少需要經過______次過濾操作。
(2)“氧化”發生反應的離子方程式為__________;若用HNO3代替H2O2不足之處是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常溫下,在Fe(OH)3懸濁液中,當溶液的pH=3.0時,Fe3+的濃度為________mol/L。
②實際生產過程中,“調節pH”生成沉淀時,溶液pH與金屬元素的沉淀百分率(ω)的關系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
則最佳的沉淀pH=________。
(4)“沉鋰" 時的溫度應選(填標號)______為宜,并用___洗滌(填“熱水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亞鐵鋰電池在工作時,正極發生LiFePO4和FePO4的轉化,該電池放電時正極的電極反應式為________。
(6)工業上可以用FePO4、Li2CO3和H2C2O4作原料高溫焙燒制備 LiFePO4,該反應的化學方程式為________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將下列物質的溶液在蒸發皿中加熱蒸干并灼燒(400℃),可以得到該物質的固體的是( )
A. AlCl3 B. NaHCO3
C. MgSO4 D. KMnO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是指導化學學習的重要工具,下圖為元素周期表的一部分,請按要求填空:

(1)N在元素周期表中的位置是______________ ;N和F處于同一行,是由于它們的 __________ 相同。
(2)以上元素中,原子半徑最小的是 ________ (寫元素符號);最高價氧化物對應水化物中酸性最強的是 ______________ (寫化學式)。
(3)Mg和Al中,金屬性較強的是 __________ (寫元素符號),寫出一條能說明該結論的事實_________________________________。
(4) S和Cl中,非金屬性較強的是 __________ (寫元素符號),不能說明該結論的事實是_________。
a.氯氣與鐵反應生成 FeCl3,硫與鐵反應生成FeS
b.把 Cl2通入 H2S溶液中能發生置換反應
c.受熱時 H2S易分解,HCl不易分解
d.單質硫是固體,氯的單質是氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】F2和Xe在一定條件下可生成XeF2、XeF4和XeF6三種氟化氙,它們都是極強的氧化劑(其氧化性依次遞增),都極易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推測正確的是( )

A. XeF2分子中各原子均達到八電子結構
B. 某種氟化氙的晶體結構單元如圖,可推知其化學式為XeF6
C. XeF4按已知方式水解,每生成4molXe,轉移16mol電子
D. XeF2加入水中,在水分子作用下將重新生成Xe和F2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com