設NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.精煉銅過程中陰極增重6.4g時,電路中轉移電子數大于0.2NA
B.通常狀況下,將0.5mol HI氣體和0.5mol氯氣混合后氣體的分子數為NA
C.18g2H218O所含的中子數為1.8NA
D.53g碳酸鈉固體所含離子數為1.5NA
【答案】
分析:A、根據精煉銅的原理和電極反應計算分析;
B、依據碘化氫和氯氣能發生氧化還原反應,結合化學方程式計算分析;
C、質量換算物質的量結合分子式,利用質量數=中子數+質子數進行計算;
D、質量換算物質的量計算固體中所含離子數.
解答:解:A、精煉銅陽極為粗銅發生電極反應為Cu-2e
-=Cu
2+、Fe-2e
-=Fe
2+、Zn-2e
-=Zn
2+、Ni-2e
-=Ni
2+;陰極反應:Cu
2++2e
-=Cu,陰極增重6.4g時物質的量為0.1mol,電子轉移為0.2mol,故A錯誤;
B、0.5molHI氣體和0.5mol氯氣混合后發生反應:2HI+Cl
2=I
2+2HCl,0.5molHI全部反應需要Cl
20.25mol,生成HCl的物質的量為0.5mol,剩余Cl
20.25mol,生成的I
2在通常狀況下為固體,剩余生成的氣體物質的量為0.75mol,故B錯誤;
C、18g
2H
218O物質的量為
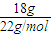
,所含的中子數為
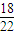
mol×(1×2+18-8)×N
A=9.8N
A,故C錯誤;
D、53g碳酸鈉固體物質的量為
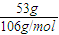
=0.5mol,含離子數為含鈉離子為1mol,碳酸鈣離子0.5mol,共1.5mol離子,即1.5N
A,故D正確;
故選D.
點評:本題考查了阿伏伽德羅常數的應用,主要考查粗銅精煉的原理應用,氧化還原反應的計算,質量換算物質的量,結合質量數=中子數+質子數的計算微粒數,關鍵是D選項是固體中的離子數計算.

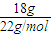 ,所含的中子數為
,所含的中子數為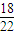 mol×(1×2+18-8)×NA=9.8NA,故C錯誤;
mol×(1×2+18-8)×NA=9.8NA,故C錯誤;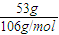 =0.5mol,含離子數為含鈉離子為1mol,碳酸鈣離子0.5mol,共1.5mol離子,即1.5NA,故D正確;
=0.5mol,含離子數為含鈉離子為1mol,碳酸鈣離子0.5mol,共1.5mol離子,即1.5NA,故D正確;
