
氨的合成原理為:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如右圖。回答下列問題:
2NH3(g) ;△H= —92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如右圖。回答下列問題: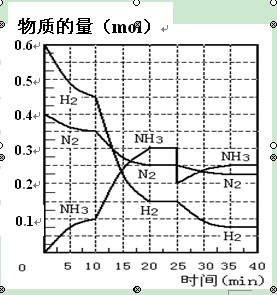
(1)10 min內(nèi)以NH3表示的平均反應(yīng)速率 ;
(2)在10 ~20 min內(nèi):NH3濃度變化的原因可能是 ;
| A.加了催化劑 | B.縮小容器體積 | C.降低溫度 | D.增加NH3物質(zhì)的量 |
(12分,每空2分)(1) v = 0.005 mol·L-1 ·min-1 (沒有單位不給分)
(2) AB (漏選得1分,錯選不給分)
(3): 20~25 min K1 = 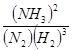 45.5 %
45.5 %
(4) 移走0.1 mol NH3(沒有指出0.1mol的給1分)
解析試題分析:(1)根據(jù)圖像可知,10min時氨氣的物質(zhì)的量是0.1mol,所以氨氣的反應(yīng)速率是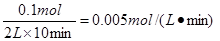 。
。
(2)根據(jù)圖像可知,在10 ~20 min內(nèi)NH3濃度增加,氮氣和氫氣的濃度減小,這說明反應(yīng)向正反應(yīng)方向進(jìn)行。因為該反應(yīng)是體積減小的、放熱的可逆反應(yīng),所以改變的條件可能是縮小容器體積或降低溫度,答案選BC。
(3)根據(jù)圖像可知,在20 ~25 min內(nèi)各種物質(zhì)的濃度不再發(fā)生變化,即反應(yīng)達(dá)到平衡狀態(tài),所以第1次平衡的時間范圍為20 ~25 min。化學(xué)平衡常數(shù)是在一定條件下,當(dāng)可逆反應(yīng)達(dá)到平衡狀態(tài)時,生成物濃度的冪之積和反應(yīng)物濃度的冪之積的比值,所以根據(jù)反應(yīng)的方程式可知,該反應(yīng)的平衡常數(shù)K1=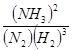 ;同樣根據(jù)圖像可知,反應(yīng)進(jìn)行到35min時,各種物質(zhì)的濃度不再發(fā)生變化,即反應(yīng)達(dá)到平衡狀態(tài)。此時氫氣、氮氣和氨氣的物質(zhì)的量分別是0.075mol、0.225mol、0.25mol,所以第2次平衡時NH3的體積分?jǐn)?shù)是
;同樣根據(jù)圖像可知,反應(yīng)進(jìn)行到35min時,各種物質(zhì)的濃度不再發(fā)生變化,即反應(yīng)達(dá)到平衡狀態(tài)。此時氫氣、氮氣和氨氣的物質(zhì)的量分別是0.075mol、0.225mol、0.25mol,所以第2次平衡時NH3的體積分?jǐn)?shù)是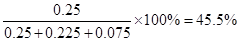 。
。
(4)根據(jù)圖像可知,在25 min時,氨氣的物質(zhì)的量由0.3mol降低到0.2mol,所以改變的條件是移走了0.1molNH3。
考點:考查反應(yīng)速率的計算、平衡常數(shù)的判斷、外界條件對平衡狀態(tài)的影響以及有關(guān)計算
點評:該題是中等難度的試題,也是高考中的常見題型。試題綜合性強,側(cè)重對學(xué)生能力的培養(yǎng)。試題在注重基礎(chǔ)知識鞏固,側(cè)重對學(xué)生解題方法的指導(dǎo)與訓(xùn)練。有利于調(diào)動學(xué)生的學(xué)習(xí)興趣和學(xué)習(xí)積極性。


 全能測控一本好卷系列答案
全能測控一本好卷系列答案科目:高中化學(xué) 來源: 題型:
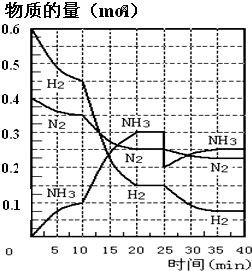 氨的合成原理為:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ?mol-1.現(xiàn)在500℃、20MPa時,將N2、H2置于一個容積為2L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如圖.回答下列問題:
氨的合成原理為:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ?mol-1.現(xiàn)在500℃、20MPa時,將N2、H2置于一個容積為2L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如圖.回答下列問題:| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
(27分)氨的合成原理為:N2(g)+3H2(g)![]() 2NH3(g) ;△H=—92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如下圖。回答下列問題:
2NH3(g) ;△H=—92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如下圖。回答下列問題:

(1)10min內(nèi)以NH3表示的平均反應(yīng)速率 ;
(2)在10~20 min內(nèi):NH3濃度變化的原因可能是 ;
A.加了催化劑 B.縮小容器體積
C.降低溫度 D.增加NH3物質(zhì)的量
(3)第1次平衡的時間范圍為: ,
第2次平衡的時間范圍為: ,
第1次平衡:平衡常數(shù)K1 = (帶數(shù)據(jù)的表達(dá)式),
第2次平衡時NH3的體積分?jǐn)?shù) ;
(4)在反應(yīng)進(jìn)行至25 min時:
① 曲線發(fā)生變化的原因:
② 達(dá)第二次平衡時,新平衡的平衡常數(shù)
K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40min時,計算合成氨過程中的反應(yīng)熱△H= 。
(6)根據(jù)最新“人工固氮”的研究報道,在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發(fā)生下列反應(yīng):
N2(g)+ 3H2O(1) ![]() 2NH3(g)+
2NH3(g)+ ![]() O2(g) ;△H = a kJ·mol—1
O2(g) ;△H = a kJ·mol—1
進(jìn)一步研究NH3生成量與溫度的關(guān)系,常壓下達(dá)到平衡時測得部分實驗數(shù)據(jù)如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反應(yīng)的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g)+ O2(g) = 2H2O(l)= -571.6kJ·mol—1
則常溫下氮氣與水反應(yīng)生成氨氣與氧氣的熱化學(xué)方程式為:
查看答案和解析>>
科目:高中化學(xué) 來源:2011-2012學(xué)年江西省南昌三中高二上學(xué)期期中考試化學(xué)試卷(帶解析) 題型:填空題
(17分)氨的合成原理為:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如圖。
2NH3(g);△H= —92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如圖。
回答下列問題:
(1)10 min內(nèi)以NH3表示的平均反應(yīng)速率 ;
(2)在10 ~20 min內(nèi):NH3濃度變化的原因可能是 ;
| A.加了催化劑 | B.縮小容器體積 | C.降低溫度 | D.增加NH3物質(zhì)的量 |
 2NH3(g) +
2NH3(g) +  O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1查看答案和解析>>
科目:高中化學(xué) 來源:2014屆福建省高二第二次月考化學(xué)試卷(解析版) 題型:填空題
(16分)氨的合成原理為:N2(g)+3H2(g) 2NH3(g)
;△H= —92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如下圖。回答下列問題:
2NH3(g)
;△H= —92.4 KJ·mol—1。現(xiàn)在500℃、20 MPa時,將N2、H2置于一個容積為2 L的密閉容器中發(fā)生反應(yīng),反應(yīng)過程中各物質(zhì)的物質(zhì)的量變化如下圖。回答下列問題:
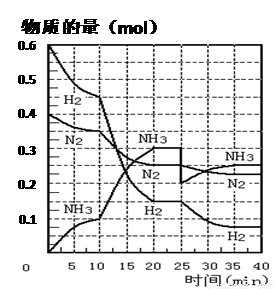
(1)10 min內(nèi)以NH3表示的平均反應(yīng)速率 ;
(2)在10 ~20 min內(nèi):NH3濃度變化的原因可能是 ;
A.加了催化劑 B.縮小容器體積
C.降低溫度 D.增加NH3物質(zhì)的量
(3)第1次平衡的時間范圍為: ,第2次平衡的時間范圍為: ,第1次平衡:平衡常數(shù)K1 = (帶數(shù)據(jù)的表達(dá)式),第2次平衡時NH3的體積分?jǐn)?shù) ;
(4)在反應(yīng)進(jìn)行至25 min時:① 曲線發(fā)生變化的原因: ② 達(dá)第二次平衡時,新平衡的平衡常數(shù)K2 K1(填“大于”、“等于”、“小于”)
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com