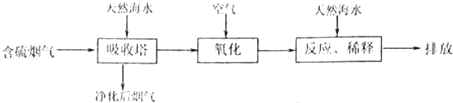
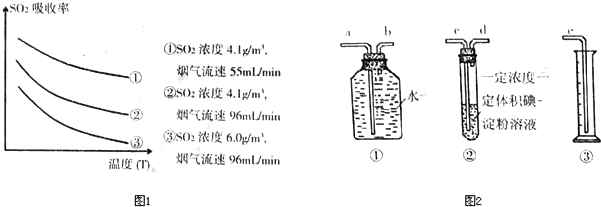
解:(1)①總體來看,SO
2的吸收效率隨溫度的升高而降低,當溫度和濃度相同時,SO
2的吸收效率隨煙氣流速的增大而降低,當溫度和煙氣流速相同時,SO
2的吸收效率隨SO
2濃度的增大而降低,同時根據生石灰能與水反應生成堿,堿能與SO
2反應;所以為了提高一定濃度含硫煙氣中SO
2的吸收效率,可通過降低通入含硫煙氣的溫度,減小通入含硫煙氣的流速以及在天然海水中加入生石灰;故答案為:ABD;
②由空氣中的氧氣將H
2SO
3氧化為硫酸,該反應為2H
2SO
3+O
2=2H
2SO
4,
故答案為:2H
2SO
3+O
2=2H
2SO
4;
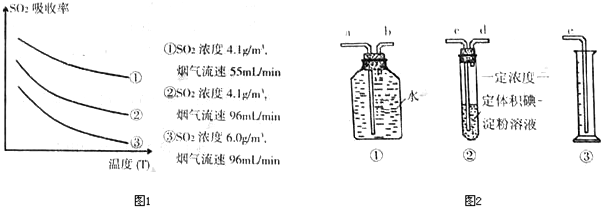
③該實驗的測定原理為:煙氣通過一定濃度一定體積的碘-淀粉溶液,其中的SO
2與碘反應,當恰好反應時,溶液的藍色消失,根據碘的物質的量可以求出SO
2的物質的量,余下的氣體排入廣口瓶,將水壓入量筒,由量筒中的水的體積可以確定剩余氣體的體積,最后求出SO
2體積分數;測定模擬煙氣中SO
2的體積分數,可根據二氧化硫氣體的還原性,與具有氧化性的酸性高錳酸鉀或溴水反應,通過顏色的變化判斷,選項中AC符合,都有顏色,且都具有氧化性,能與二氧化硫反應,故選:cdbae;AC;
(2)二氧化硫與碳酸鈣反應生成亞硫酸鈣與二氧化碳,反應方程式為:SO
2+CaCO
3=CaSO
3+CO
2,亞硫酸鈣在水存在的條件下被氧氣氧化生成CaSO
4?2H
2O,反應方程式為:2CaSO
3+O
2+4H
2O=2(CaSO
4?2H
2O),總反應為:2CaCO
3+2SO
2+O
2+4H
2O═2(CaSO
4?2H
2O)+2CO
2;
故答案為:SO
2+CaCO
3=CaSO
3+CO
2;2CaSO
3+O
2+4H
2O=2(CaSO
4?2H
2O);
S~SO
2 ~CaSO
4?2H
2O
32 172
300t×2.5%×96% m
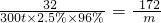
,解得m=38.7t,
故答案為:38.7;
分析:(1)①總體來看,SO
2的吸收效率隨溫度的升高而降低,當溫度和濃度相同時,SO
2的吸收效率隨煙氣流速的增大而降低,當溫度和煙氣流速相同時,SO
2的吸收效率隨SO
2濃度的增大而降低,同時根據生石灰能與水反應生成堿,堿能與SO
2反應;
②根據使用空氣中的氧氣將H
2SO
3氧化;
③根據實驗的原理來分析;測定模擬煙氣中SO
2的體積分數,可根據二氧化硫氣體的還原性,與具有氧化性的酸性高錳酸鉀或溴水反應,通過顏色的變化判斷;
(2)二氧化硫與碳酸鈣反應生成亞硫酸鈣與二氧化碳,亞硫酸鈣在水存在的條件下被氧氣氧化生成CaSO
4?2H
2O;根據關系式S~SO
2~CaSO
4?2H
2O來計算;
點評:本題考查污染的處理,利用所學知識結合習題中的信息即可解答,習題中圖象及數據是解答本題的關鍵,較好的考查學生分析問題、解決問題的能力.

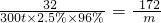 ,解得m=38.7t,
,解得m=38.7t,