
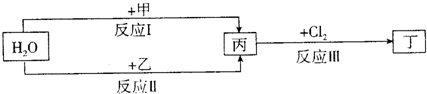
在下列物質轉化關系中,反應的條件和部分產物已略去。

回答下列問題:
(1)若甲、乙是兩種常見金屬,反應Ⅰ是工業制鹽酸的反應。
①反應I中,甲在通常條件下和水劇烈反應,除丙外,還生成一種焰色反應為黃色的物質,
則工業上生產甲的一般方法是_ 。
A.熱分解法 B.熱還原法 C.電解法
②反應Ⅱ中,乙與H2O在高溫下反應,除丙外,還生成一種有磁性的物質,則反應a的化學方程式是
③通過比較反應I、II的反應條件,可得出甲的金屬性比乙的金屬性_ (填“強”或“弱”)。
(2)若甲、乙是化合物,且反應Ⅲ是工業制漂白粉的反應。
①反應II是化合反應。目前常用乙作為燃煤的脫硫劑,則乙脫硫的主要反應的化學方程
式是
②在飽和氯水中加塊狀石灰石,能制得較濃HClO溶液,同時放出一種氣體。其反應的離
子方程式是
17.(2)①C; ②3Fe+4H2O(g)=Fe3O4+4H2(g);③強;(2)①CaO + SO2 = CaSO3 +2CaSO4; ②2Cl2 + H2O + CaCO3 = Ca2+ + 2Cl- + 2HClO + CO2
【解析】
試題分析:工業制備鹽酸的反應,丙為H2,丁為HCl,(1)反應I中,甲在通常條件下和水劇烈反應,除丙外,還生成一種焰色反應為黃色的物質,該物質含有Na元素,故甲為Na,與水反應生成氫氧化鈉,工業上制備鈉采用電解法,故選C。②反應II中,乙與H2O在高溫下反應,除丙外,還生成一種有磁性的物質,則乙為Fe,處于周期表中第四周期第Ⅷ族,生成的磁性物質為Fe3O4,反應方程式為:3Fe+4H2O(g)=Fe3O4+4H2(g),故答案為:第四周期第Ⅷ族;3Fe+4H2O(g)=Fe3O4+4H2(g);③鐵越水蒸氣在高溫條件下發生反應,鈉與水在常溫下劇烈反應,故金屬性鈉比鐵強,最高價氧化物對應水化物堿性強弱比較金屬性強弱,NaOH是強堿而Fe(OH)3是弱堿,說明金屬性鈉比鐵強,故答案為:強;NaOH是強堿而Fe(OH)3是弱堿;
(2)①燃煤的脫硫劑,主要是把二氧化硫吸收,目前主要是方法是石灰石脫硫法,方程式如答案所示。②在飽和氯水中加塊狀石灰石,能制得較濃HClO溶液,同時放出一種氣體應該是二氧化碳,方程式如答案所示。
考點:本題考查了元素推斷,考查鈉、鐵元素單質的性質等、常用化學用語書寫。


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:



| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| ||


查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2010-2011學年河南省信陽市高三第二次調研考試化學試卷 題型:填空題
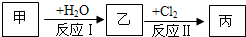
(12分)在下列物質轉化關系中,反應的條件和部分產物已略去。

回答下列問題:
(1)若甲、乙是兩種常見金屬,反應Ⅲ是工業制鹽酸的反應。
①反應I中,甲在通常條件下和水劇烈反應,除丙外,還生成一種焰色反應為黃色的物質,則工業上生產甲的一般方法是_________________。
A.熱分解法 B.熱還原法 C.電解法
②反應Ⅱ中,乙與H2O在高溫下反應,除丙外,還生成一種有磁性的物質,則反應Ⅱ的化學方程式是___________________。
③通過比較反應Ⅰ、Ⅱ的反應條件,可得出甲的金屬性比乙的金屬性_________(填“強”或“弱”)。
(2)若甲、乙是化合物,且反應Ⅲ是工業制漂白粉的反應。
①反應Ⅲ的化學方程式是________________________________。
②反應Ⅱ是化合反應。乙可與硫酸銨共熱反應制氨氣,則此反應的化學方程式是___________________。
③在飽和氯水中加塊狀石灰石,能制得較濃HClO溶液,同時放出一種氣體。其反應的離子方程式是___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com