
 已知反應:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反應:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q| 實驗編號 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
分析 (1)K為生成物濃度冪之積與反應物濃度冪之積;
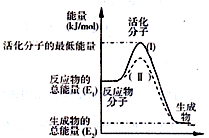
(2)由圖可知,反應物總能量大于生成物總能量,為放熱反應,使用催化劑不改變焓變,降低反應所需的活化能;
(3)由表格中的數據可知,只有濃度為變量,且反應速率與濃度的乘積成正比,以此來解答.
解答 解:(1)由3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)可知K=$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$,故答案為:$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$;
(2)由圖可知,反應物總能量大于生成物總能量,為放熱反應,則Q>0,使用催化劑不改變焓變,降低反應所需的活化能,則使用催化劑的是(II)曲線,
故答案為:>;(II);
(3)由表格中的數據可知,只有濃度為變量,該實驗的目的為研究I-、S2O82-濃度對反應速率的影響;且反應速率與濃度的乘積成正比,可知③⑤中濃度乘積相同,則t1=22s,實驗結論為反應速率與反應物濃度乘積成正比,
故答案為:研究I-、S2O82-濃度對反應速率的影響;22;反應速率與反應物濃度乘積成正比.
點評 本題考查平衡常數的意義、探究反應速率的影響因素、反應中能量變化,為高頻考點,把握K的表達式、習題中圖象及表格數據的分析為解答的關鍵,側重分析與應用能力的考查,注意(3)為解答的難點,題目難度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:解答題
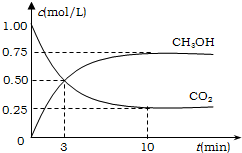 工業上有一種方法有效地開發利用CO2,是用CO2來生產燃料甲醇.為探究反應原理,進行如下實驗,在體積為1L的恒容密閉容器中,充入1molCO2和3molH2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.
工業上有一種方法有效地開發利用CO2,是用CO2來生產燃料甲醇.為探究反應原理,進行如下實驗,在體積為1L的恒容密閉容器中,充入1molCO2和3molH2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學鍵 | C-H | C-C | C═C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
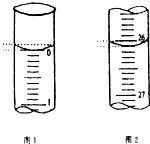 某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液時,選擇甲基橙作指示劑.請填寫下列空白:
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液時,選擇甲基橙作指示劑.請填寫下列空白:| 滴定次數 | 待測氫氧化鈉溶液的體積/mL | 0.1000mol•L-1鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熵變小于零而焓變大于零的反應肯定不能自發發生 | |
| B. | 熱化學方程式中△H的值與反應物的用量有關 | |
| C. | 化學反應中舊鍵斷裂吸收能量,新鍵形成釋放能量,所以化學反應伴隨能量變化,但反應前后物質的總能量不變 | |
| D. | 其他條件不變,增大反應物濃度是通過增大活化分子百分數,使化學反應速率加快 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在相同溫度下,飽和溶液一定比不飽和溶液導電性強 | |
| B. | 氯化鈉溶液在電流作用下電離成鈉離子和氯離子 | |
| C. | 晶體NaCl不導電,所以它不是電解質,而銅、鐵等金屬能導電,所以它們是電解質 | |
| D. | 氯化氫溶于水能導電,但液態氯化氫不導電 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 裝 置 | 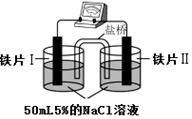 | 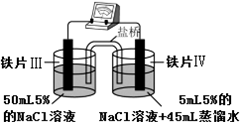 |
| 現象 | 電流計指針未發生偏轉 | 電流計指針發生偏轉 |
| A. | “電流計指針未發生偏轉”,說明鐵片Ⅰ、鐵片Ⅱ均未被腐蝕 | |
| B. | 鐵片Ⅳ的電極反應式可能為Fe-3e-=Fe3+ | |
| C. | 用K3Fe(CN)6]溶液檢驗鐵片Ⅲ、Ⅳ附近溶液,可判斷裝置的正、負極 | |
| D. | 鐵片Ⅰ、Ⅲ所處的電解質溶液濃度相同,所以二者的腐蝕速率相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com