
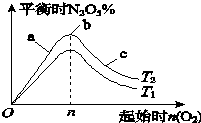
 某科研小組欲研究在其他條件不變的情況下,改變起始氧氣的物質的量對合成新型硝化劑反應4NO2(g)+O2(g)?2N2O5(g)△H<0的影響.
某科研小組欲研究在其他條件不變的情況下,改變起始氧氣的物質的量對合成新型硝化劑反應4NO2(g)+O2(g)?2N2O5(g)△H<0的影響.分析 (1)根據溫度升高化學平衡向著吸熱方向進行;
(2)根據增加氫氣的物質的量化學平衡向著正反應方向移動;
(3)平衡常數應是平衡時生成物的濃度冪之積比上反應物濃度冪之積,先求出各自的平衡濃度,然后根據平衡常數的概念來回答;
解答 解:(1)反應為放熱反應,溫度升高化學平衡向著吸熱方向進行,從T1到T2N2O5的量增加,故T1>T2,
故答案為:>;
(2)b點代表平衡狀態,c點又加入了氧氣,故平衡向右移動,NO2的轉化率增大,
故答案為:c;
(3)NO2和O2的物質的量之比為4:1,達平衡N2O5的百分含量最大,
4NO2(g)+O2(g)?2N2O5(g)
初起:4mol 1mol 0
變化:2mol 0.5mol 1mol
平衡:2mol 0.5mol 1mol
所以K=$\frac{(\frac{1}{1})^{2}}{(\frac{2}{1})^{4}×\frac{0.5}{1}}$=$\frac{1}{8}$,故答案為:$\frac{1}{8}$.
點評 本題考查了外界條件對反應速率和平衡的影響、平衡的判斷等,題目難度中等,注重高考常考點的考查,注意圖象中數據的分析.


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學 來源:2016-2017學年山東省高一上10月月考化學試卷(解析版) 題型:選擇題
如果向500ml含CaCl2和KCl的混合溶液中,加入含1mol碳酸鈉的溶液,恰好使鈣離子完全沉淀;如果向該溶液中加入含3 mol硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
A.1mol·L-1 B.2mol·L-1 C.3mol·L-1 D.4mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
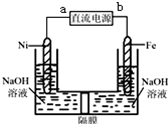 Na2FeO4是一種既能殺菌、消毒,又能絮凝凈水的水處理劑,其電解制法如圖所示,請根據圖示分析:電解過程中的電池反應為Fe+2OH-+2H2O $\frac{\underline{\;電解\;}}{\;}$FeO42-+3H2↑;每轉移0.6mol電子在Ni電極上產生的氣體在標況下的體積為6.72L;隔膜用陽離子交換膜(只允許陽離子通過)還是陰離子交換膜(只允許陰離子通過)陽離子交換膜.
Na2FeO4是一種既能殺菌、消毒,又能絮凝凈水的水處理劑,其電解制法如圖所示,請根據圖示分析:電解過程中的電池反應為Fe+2OH-+2H2O $\frac{\underline{\;電解\;}}{\;}$FeO42-+3H2↑;每轉移0.6mol電子在Ni電極上產生的氣體在標況下的體積為6.72L;隔膜用陽離子交換膜(只允許陽離子通過)還是陰離子交換膜(只允許陰離子通過)陽離子交換膜.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 催化劑可以加快化學反應速率,也能增大化學反應的焓變 | |
| B. | 常溫下,pH均為5的鹽酸與氯化銨溶液中,水的電離程度相同 | |
| C. | 25℃下,在NH3•H2O稀溶液中加水稀釋,$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值不變 | |
| D. | 在NaHS溶液中,滴入少量CuCl2溶液產生黑色沉淀,HS-電離程度減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
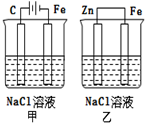
| A. | 甲裝置是犧牲陽極的陰極保護法 | |
| B. | 乙裝置是犧牲陽極的陰極保護法 | |
| C. | 一段時間后甲、乙裝置中pH均增大 | |
| D. | 甲、乙裝置中鐵電極的電極反應式均為:2H++2e→H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在NaAlO2溶液中通入過量CO2:AlO2-+4CO2+2H2O═Al3++4HCO3- | |
| B. | Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| C. | 用Fe(NO3)2溶液加入HCl溶液:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | FeBr2溶液通入少量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
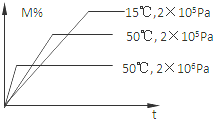 在密閉容器中進行反應:M(g)+N(g)?R(g)+2L,此反應符合下圖關系,該反應是下列哪種情況( )
在密閉容器中進行反應:M(g)+N(g)?R(g)+2L,此反應符合下圖關系,該反應是下列哪種情況( )| A. | 正反應吸熱,L是固體或液體 | B. | 正反應吸熱,L是氣體 | ||
| C. | 正反應放熱,L是固體或液體 | D. | 正反應放熱,L是氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com