
【題目】電滲析法是一種利用離子交換膜進行海水淡化的方法,原理如圖所示,淡水最終在X和Z室中流出。下列說法不正確的是
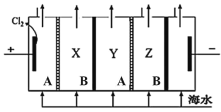
A.一般海水中含有的 Ca2+、Mg2+容易生成沉淀堵塞離子交換膜,因此不能直接通入陰極室
B.陽極發生電極反應:2Cl2e=Cl2↑
C.電滲析過程中陰極附近pH值升高
D.A膜為陽離子交換膜,B膜為陰離子交換膜
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】反應N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法不正確的是
2NO2(g) ΔH=+57kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法不正確的是
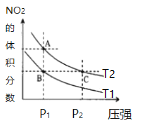
A.A點的反應速率小于C點的反應速率
B.A、C兩點氣體的顏色:A淺,C深
C.由狀態B到狀態A,可以用降溫的方法
D.A、C兩點氣體的平均相對分子質量:A<C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯(ClO2)是極易溶于水且不與水發生化學反應的黃綠色氣體,沸點為11℃。某小組在實驗室中擬用下圖所示裝置制取并收集C1O2。冋答下列問題:
(1)C1O2的制備
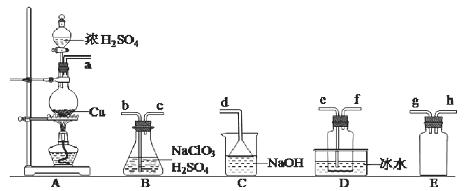
已知:SO2 +2NaClO3 +H2SO4 =2C1O2↑+2NaHSO4
①裝置A中反應的化學方程式為_________________________。
②欲收集干燥的C1O2,選擇上圖中的裝罝,其連接順序為a→____________(按氣流方向,用小寫字母表示)。
③裝置D的作用是_________________。
④若沒有E裝置,會造成的嚴重后果是____________________。
(2)ClO2很不穩定,需隨用隨制,產物用水吸收得到ClO2溶液.為測定所得溶液中ClO2的含量,進行了下列實驗:
步驟1:準確量取ClO2溶液10.00mL,稀釋成100.00mL試樣;量取V1mL試樣加入到錐形瓶中;
步驟2:調節試樣的pH≤2.0,加入足量的KI晶體,靜置片刻;
步驟3:加入淀粉指示劑,用c mol/LNa2S2O3溶液滴定至終點,消耗Na2S2O3溶液V2mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①步驟2的反應中氧化產物的電子式為______。
②滴定終點的實驗現象是_________________。
③原C1O2溶液的濃度為____g/L(用少驟中的字母代數式表示)。
④若滴定前滴定管尖嘴中有氣泡,滴定后氣泡消失,則測定結果_______;若滴定開始仰視讀數,滴定終點時正確讀數,則測定結果_____。(填“偏高”“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了實現資源利用最大化,某化工廠將合成氨、制純堿和生產尿素![]() 工藝聯合,簡易流程如下:
工藝聯合,簡易流程如下:

![]() 時101kPa時,測得生成17g
時101kPa時,測得生成17g![]() ,放出
,放出![]() 熱量,寫出合成
熱量,寫出合成![]() 的熱化學方程式 ______ .
的熱化學方程式 ______ .
![]() 合成氨原料氣中的雜質硫化氫用稀氨水吸收,副產品是酸式鹽.該副產品的化學式為 ______ .
合成氨原料氣中的雜質硫化氫用稀氨水吸收,副產品是酸式鹽.該副產品的化學式為 ______ .
![]() 反應器2分離出來的氮氣和氫氣再通入反應器1,其目的是 ______
反應器2分離出來的氮氣和氫氣再通入反應器1,其目的是 ______ ![]() 向反應器3充入原料的順序是:先加氯化鈉溶液,通入氨氣至飽和,再通入足量的二氧化碳可制得
向反應器3充入原料的順序是:先加氯化鈉溶液,通入氨氣至飽和,再通入足量的二氧化碳可制得![]() 反應器3中的化學方程式為 ______ .
反應器3中的化學方程式為 ______ .
![]() 工業上可用碳、甲烷與水蒸汽反應制氫氣
工業上可用碳、甲烷與水蒸汽反應制氫氣
![]() ,
,![]() ,此反應的化學平衡常數表達式為
,此反應的化學平衡常數表達式為![]() ______ ,為了提高碳的轉化率,宜采用下列措施中的
______ ,為了提高碳的轉化率,宜采用下列措施中的![]() 填字母編號
填字母編號![]() ______ .
______ .
A.增大壓強![]() 增加碳的量
增加碳的量![]() 升高溫度
升高溫度![]() 增加水的量
增加水的量![]() 使用催化劑
使用催化劑![]() 及時移出CO、
及時移出CO、![]()
![]() 有些國家水電豐富,采用惰性電極電解硫酸鈉溶液制氫氣,電解時陽極上的電極反應式為 ______
有些國家水電豐富,采用惰性電極電解硫酸鈉溶液制氫氣,電解時陽極上的電極反應式為 ______
![]() 若僅以
若僅以![]() 、空氣、
、空氣、![]() 為原料制尿素
為原料制尿素 ,標準狀況下
,標準狀況下![]()
![]() ,理論上最多能制 ______
,理論上最多能制 ______ ![]() 尿素.
尿素.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究苯酚與FeCl3溶液的顯色反應,實驗如下。下列說法不正確的是
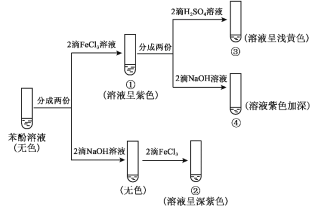
A.對比①③中的現象,說明滴加稀硫酸后,c(Fe3+)變小
B.向試管②中滴加硫酸至過量,溶液顏色變為淺黃色
C.對比①②、①④中的現象,說明紫色物質的生成與溶液中 c(C6H5O)相關
D.對比①②、①④中的現象,說明結合C6H5O的能力:H+>Fe3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物 Z 的結構簡式為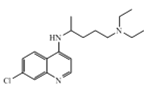 ,常進一步修飾后制成注射液使用,也可制成口服劑。如圖為化合物 Z 的一種合成路線,先分別合成化合物F和Y,最后再用F 和 Y 反應獲得化合物Z。
,常進一步修飾后制成注射液使用,也可制成口服劑。如圖為化合物 Z 的一種合成路線,先分別合成化合物F和Y,最后再用F 和 Y 反應獲得化合物Z。
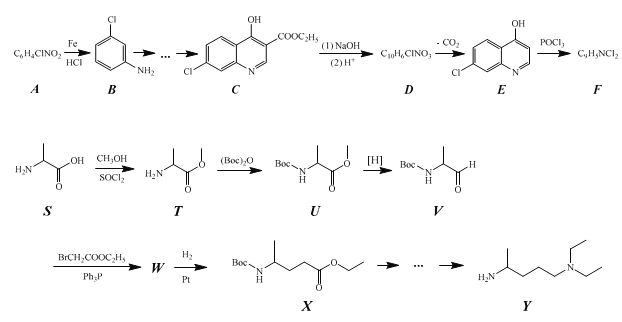
已知:
①![]()
![]()
![]()
②(Boc)2O=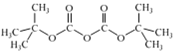 (其中Boc=
(其中Boc=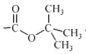 ,作答時建議用縮寫符號來表示)
,作答時建議用縮寫符號來表示)
③Ph3P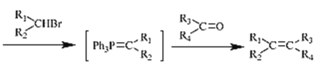 (其中-Ph為苯基,不考慮順反異構)
(其中-Ph為苯基,不考慮順反異構)
(1)化合物A 中含氧官能團的名稱為__。
(2)生成化合物B的反應類型為__,由化合物F 和 Y 合成化合物Z 的反應類型為__。
(3)化合物C與足量NaOH水溶液反應,即化合物C到化合物D的轉化步驟(1)的化學方程式為__。
(4)由化合物T到化合物U的反應還生成了CO2和一種醇,請寫出這個醇的結構簡式__。將化合物T與(Boc)2O反應制成化合物U再進行后續反應的目的是__。
(5)化合物W 的結構簡式為__。
(6)作為藥物時,化合物 Z 往往要進一步與磷酸反應制成磷酸鹽使用。這么做的原因是:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水是一種重要的自然資源,水質優劣直接影響人體健康,水處理技術在生產、生活中應用廣泛。聚合硫酸鐵(PFS)是水處理中重要的絮凝劑。以黃鐵礦的燒渣(主要成分為Fe2O3、FeO、SiO2等)和廢鐵屑為原料制取聚合硫酸鐵([Fe2(OH)x(SO4)3-![]() ]m)的工藝流程如圖:
]m)的工藝流程如圖:
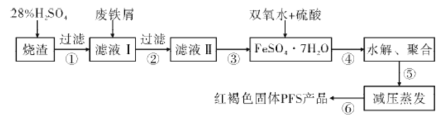
(1)用98%的硫酸配制28%的硫酸,所需的玻璃儀器除量筒外,還有______(填標號)。
a.容量瓶 b.燒杯 c.玻璃棒 d.分液漏斗
(2)廢鐵屑表面附有鐵銹,鐵銹的主要成分為______,步驟③的具體實驗操作有____。
(3)水解、聚合要嚴控pH和溫度。pH偏小時Fe3+水解程度弱,pH偏大時則______。寫出水解、聚合反應生成PFS的化學方程式:_________。
(4)步驟⑥相對于常壓蒸發,減壓蒸發的優點是_________。
(5)污水經過一級、二級處理后,還含有少量Cu2+、Hg2+、Pb2+等重金屬離子,可加入沉淀劑使其沉淀。下列物質能作為沉淀劑的是_______(填標號)。
a.氨水 b.硫化氫氣體 c.硫酸鈉溶液 d.純堿溶液
(6)硬度為1°的水是指每升水含10mgCaO或與之相當的物質(如7.1mgMgO)。若某天然水中c(Ca2+)=1.5×10-3mol/L,c(Mg2+)=6.4×10-4mol/L,則此水的硬度為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ZnSe是一種光電性能優異的半導體材料,某研究小組用如圖1方法制備了ZnSe.

![]() 溶于水生成
溶于水生成![]() ,下列物質與水反應,跟此反應類型相同的是 ______
,下列物質與水反應,跟此反應類型相同的是 ______
![]()
![]()
![]()
![]()
![]()
![]() 硒酸
硒酸![]() 的水溶液按下式發生一級和二級電離:
的水溶液按下式發生一級和二級電離:![]() ;
;![]() ,
,![]()
![]() 溶液顯 ______
溶液顯 ______ ![]() 填“酸性”、“中性”、“堿性”
填“酸性”、“中性”、“堿性”![]() .
.
![]() 向
向![]() 溶液中滴加少量氨水,該反應的離子方程式為 ______ .
溶液中滴加少量氨水,該反應的離子方程式為 ______ .
![]() 已知
已知![]() 的兩級電離常數分別為
的兩級電離常數分別為![]() ,
,![]() ,則
,則![]() 和
和![]() 兩溶液混合后反應的離子方程式為 ______ .
兩溶液混合后反應的離子方程式為 ______ .
![]() 肼
肼![]() 與
與![]() 反應的氧化產物是
反應的氧化產物是![]() 氧化劑與還原劑的物質的量之比為 ______ .
氧化劑與還原劑的物質的量之比為 ______ .
![]() 電化學降解法可用于治理水中硝酸鹽的污染,所得產物可直接排入大氣.其原理如圖2所示,其中B為電源的 ______ 極,乙池中電極反應式為 ______ ,為使反應持續進行,須適時向甲池中添加 ______ .
電化學降解法可用于治理水中硝酸鹽的污染,所得產物可直接排入大氣.其原理如圖2所示,其中B為電源的 ______ 極,乙池中電極反應式為 ______ ,為使反應持續進行,須適時向甲池中添加 ______ .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com