
 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源:2016-2017學年山西省高二下學期第一次月考化學試卷(解析版) 題型:
“各能級最多容納的電子數,是該能級原子軌道數的二倍”,支撐這一結論的理論是( )
A. 構造原理 B. 泡利原理 C. 洪特規則 D. 能量最低原理
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一3月學生學業能力調研(文)化學試卷(解析版) 題型:選擇題
某元素原子最外層上只有兩個電子,該元素
A. 一定是ⅡA族元素 B. 一定是金屬元素
C. 可能是過渡元素 D. 可能是稀有氣體元素
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一3月學生學業能力調研(文)化學試卷(解析版) 題型:選擇題
HF、H2O、CH4、SiH4四種氣態氫化物按穩定性由弱到強排列正確的是
A.CH4<H2O<HF<SiH4B.SiH4<HF<CH4<H2O
C.SiH4<CH4<H2O<HFD.H2O<CH4<HF<SiH4
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一3月學生學業能力調研(文)化學試卷(解析版) 題型:選擇題
下列粒子的結構示意圖中,表示氟離子的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2017屆河南省鄭州、平頂山、濮陽市高三第二次質量預測(二模)理綜化學試卷(解析版) 題型:簡答題
鐵及其化合物在工農業生產中有重要的作用。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(g) △H3=-1651.0kJ/mol
CO還原氧化鐵的熱化學方程式為_______________________。
(2)高爐煉鐵產生的高爐氣中含有CO、H2、CO2等氣體,利用CO和H2在催化劑作用下合成甲醇,是減少污染、節約能源的一種新舉措,反應原理如下:CO(g)+2H2(g)=CH3OH(g) △H 。在體積不同的兩個恒容密閉容器中分別充入1molCO和2moL H2,測得平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化如下圖。
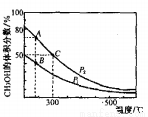
①在上圖A、B、C三點中,選填下表物理且對應最大的點。
反應速率 | 平衡常數K | 平衡轉化率a |
_________ | _________ | _________ |
②在300℃時,向C點平衡體系中再充入0.25molCO、0.5molH2和0.25mol的CH3OH,該反應向_________方向進行(城“正反應”、‘逆反應”或“不移動”)。
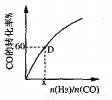
③一定溫度下,CO的轉化率與起始投料比[n(H2)/n(CO)]的變化關系如圖所示,測得D點氫氣的轉化率為40%,則x=_____________。
(3)三氯化鐵是一種重要的化合物,可以用來腐蝕電路板。某腐蝕廢液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[ c(Fe3+)≤4×l0-19]而Cu2+不沉淀,則需控制溶液pH的范圍為_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38〕
(4)高鐵酸鉀(K2FeO4)是一種新型、高效、多功能綠色水處理劑,工業上通過電解濃NaOH 溶液可制備Na2FeO4,然后轉化為K2FeO4,電解原理如下圖所示。
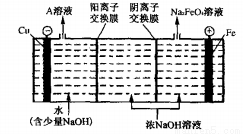
則A溶液中溶質的成分為___________________(填化學式);陽極的電極反應式為_____________
查看答案和解析>>
科目:高中化學 來源:2017屆河南省鄭州、平頂山、濮陽市高三第二次質量預測(二模)理綜化學試卷(解析版) 題型:選擇題
X、Y、Z是一種短周期元索,原子半徑的大小為:r(Y)>r(X)>r(Z),三種元素的原子序數之和為15;X、Y、Z三種元素的常見單質在適當條件下可發生右下圖轉化關系.其中R為10電子分子,是一種常見的無機溶劑。下列說法中不正確的是
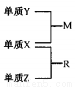
A. X元素位于周期表中第16列
B. X、Y、Z元素兩兩之間均能形成原子個數比為l:1的化合物
C. X、Y、Z元素形成的單質均具有強還原性
D. R的沸點高于M的沸點
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二學業水平測試化學試卷(解析版) 題型:選擇題
高爐煉鐵中存在反應:3CO+Fe2O3 3CO2+2Fe。下列說法正確的是
3CO2+2Fe。下列說法正確的是
A. CO是氧化劑 B. CO是還原劑
C. CO既是氧化劑又是還原劑 D. CO既不是氧化劑又不是還原劑
查看答案和解析>>
科目:高中化學 來源:2017屆黑龍江省哈爾濱市高三二模理科綜合化學試卷(解析版) 題型:填空題
金屬鎵是一種廣泛用于電子工業和通訊領域的重要金屬,化學性質與鋁元素相似。
(1)工業上提純鎵的方法很多,其中以電解精煉法為多。具體原理如下:以待提純的粗鎵(內含Zn、Fe、Cu雜質)為陽極,以高純鎵為陰極,以NaOH水溶液為電解質溶液。在電流作用下使粗鎵在陽極溶解進入電解質溶液,并通過某種離子遷移技術到達陰極并在陰極放電析出高純鎵。
①已知離子氧化性順序為:Zn2+<Ga3+<Fe2+<Cu2+。電解精煉鎵時陽極泥的成分是_________________。
②GaO2-在陰極放電的電極方程式是_______________________。
(2)工業上利用柜臺Ga與NH3高溫條件下合成固體半導體材料氮化鎵(GaN)同時又有氫氣生成。反應中每生成3mol H2時就會放出30.8kJ熱量。
①該反應的熱化學方程式為__________________。
②一定條件下,加入一定量的Ga與NH3進行上述反應,下列敘述符合事實且可作為判斷反應已達到平衡狀態的標志的是_________________。
A.恒溫恒壓下,混合氣體的密度不變
B.斷裂3molH-H鍵,同時斷裂2molN-H鍵
C.恒溫恒壓下達平衡,加入2molH2使平衡移動,NH3的消耗速率等于原平衡時NH3的消耗速率
D.升高溫度,氫氣的生成速率先增大再減小,最后不變
(3)在密閉容器中,充入一定量的Ga與NH3發生反應,實驗測得反應平衡體系中NH3的體積分數與壓強的關系曲線如圖1所示。
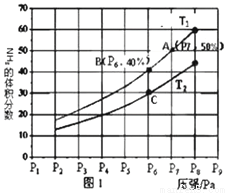
①比較圖1中A點和C點化學平衡常數的大小關系:K1A1________________K1C1,(填“<”、“=”或“>”),理由是________________________________
②在T1和P6的條件下,往密閉容器中充入2molNH3和足量的Ga,該反應在第5min時達到平衡,此時容器的體積為3L。
a.若溫度保持T1℃不變,壓強恒定在P7的條件下重新達到平衡狀態A(P7、50%)時,容器的體積變為起始體積的______________倍。
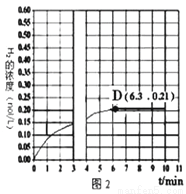
b.若T1和P6條件下反應至3min時刻,改變條件并與D點處達到平衡,H2的濃度隨反應時間的變化趨勢如圖2所示(3~4min的濃度變化未表示出來),則改變的條件為_________(僅改變溫度或壓強中的一種)
(4)在工業上利用N2(g)+3H2(g)  2NH3(g)合成氮氣。對于氣相反應,用某組份(B)的平衡壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作Kp),且PB=P×B的體積分數。則該反應的化學平衡常數表達式(Kp)是_____。恒溫恒壓下,在一容積可變的容器中,該反應達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3molN2,則平衡_________移動(填“正向”、“逆向”或“不”)。
2NH3(g)合成氮氣。對于氣相反應,用某組份(B)的平衡壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作Kp),且PB=P×B的體積分數。則該反應的化學平衡常數表達式(Kp)是_____。恒溫恒壓下,在一容積可變的容器中,該反應達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3molN2,則平衡_________移動(填“正向”、“逆向”或“不”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com