
 CO(g)+H2(g)?131.4 kJ。
CO(g)+H2(g)?131.4 kJ。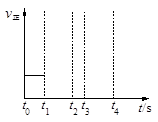
 CH3OH(g) ②CO(g) + CH3OH(g)
CH3OH(g) ②CO(g) + CH3OH(g) HCOOCH3(g)
HCOOCH3(g)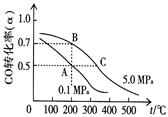
 CO(g)+H2(g) △m↑
CO(g)+H2(g) △m↑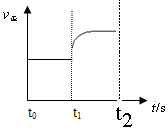 。
。 。
。

 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:不詳 題型:填空題
 CO2(g)+H2(g)某研究小組分別在體積均為2L的恒容密閉容器中加入一定量的反應物,使其發生反應,相關數據如下:
CO2(g)+H2(g)某研究小組分別在體積均為2L的恒容密閉容器中加入一定量的反應物,使其發生反應,相關數據如下:| 容器編號 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡的時間/min | 達到平衡時體系能量的變化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4 |
| ② | 650 | 2 | 4 | | | t1 | Q1 |
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 |
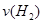 =__________。
=__________。 CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
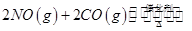
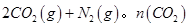 隨溫度(T)、壓強(P)和時間(t)的變化曲線如圖所示。請回答下列問題:
隨溫度(T)、壓強(P)和時間(t)的變化曲線如圖所示。請回答下列問題: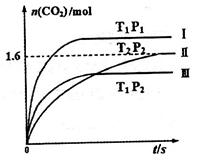
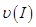 、
、 、
、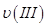 ,則三者大小關系為______________。
,則三者大小關系為______________。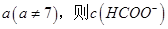 ________
________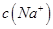 (填“>”、“=”或“<”),則HCOO-的水解平衡常數(Kh)可近似表示為______________(用含a的代數式表示)。
(填“>”、“=”或“<”),則HCOO-的水解平衡常數(Kh)可近似表示為______________(用含a的代數式表示)。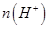 b.
b.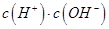 c.
c.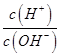 d.
d.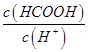
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密閉容器中反應達到平衡時,下列說法一定正確的是
qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密閉容器中反應達到平衡時,下列說法一定正確的是| A.通入氦氣使密閉容器中壓強增大,平衡向正反應方向移動 |
| B.增加X的物質的量,混合氣體的密度減小 |
| C.降低溫度,混合氣體的平均相對分子質量增大 |
| D.X的正反應速率是Y的逆反應速率的m/n倍 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2SO3(g) +Q
2SO3(g) +Q
| A.圖一研究的是溫度、壓強對平衡的影響,橫坐標表示壓強 |
| B.圖二研究的是溫度對平衡的影響,Ⅱ采用的溫度更高 |
| C.圖三中t0時使用了催化劑,使平衡向正反應方向進行 |
| D.圖四中t0時增大壓強,使平衡向正反應方向進行 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol| 溫度 | 時間/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.對于平衡體系:H2(g)+I2(g)==2HI(g),其它條件不變時,增大體系壓強,平衡向正反應方向移動,體系顏色加深 |
| B.—定溫度下,物質的量濃度相同的4種溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小順序是④>③>①>② |
| C.0.1mol?L-1的氨水加水稀釋后,NH3?H2O的電離程度增大,c(OH-)增大,c(H+)減小 |
| D.常溫下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2SO3,該反應正反應是放熱反應,下列說法不正確的是( )
2SO3,該反應正反應是放熱反應,下列說法不正確的是( )| A.升高溫度可提高反應速率 |
| B.使用催化劑能增大反應速率 |
| C.增大氧氣濃度可提高SO2的轉化率 |
| D.達到化學平衡時正逆反應速率相等且都為零 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

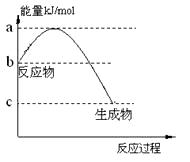
 Cr2O72-(橙色) + H2O
Cr2O72-(橙色) + H2O| A.Fe2+ | B.HCO3- | C.Ba2+ | D.Fe3+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com