
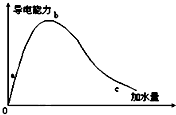
 在一定溫度下,冰醋酸加水稀釋的過程中,溶液的導電能力如圖所示,請回答:
在一定溫度下,冰醋酸加水稀釋的過程中,溶液的導電能力如圖所示,請回答:分析 (1)溶液是通過離子的定向移動形成電流的;
(2)溶液的導電能力與離子濃度成正比;
(3)溶液越稀,醋酸的電離程度越大;
(4)若使C點溶液中[CH3COO-]增大,而[H+]減小,可以向溶液中加入某些和氫離子反應的物質.
解答 解:(1)溶液是通過離子的定向移動形成電流的,冰醋酸中醋酸以分子存在,不存在離子,所以冰醋酸不導電,
故答案為:醋酸為共價化合物,在固、液態時不存在自由移動的離子,所以不導電;
(2)溶液的導電能力與離子濃度成正比,根據圖象知,溶液導電能力大小順序是b>a>c,則氫離子濃度由小到大順序是c<a<b,則pH由小到大的順序為b<a<c;
故答案為:b<a<c;
(3)溶液越稀,醋酸的電離程度越大,根據圖象知,溶液體積大小順序是c>b>a,所以醋酸電離程度最大的是c,
故答案為:c;
(4)若使C點溶液中[CH3COO-]增大,而[H+]減小,可以向溶液中加入某些和氫離子反應的物質,如堿、酸性小于醋酸的鹽、活潑金屬等,
故答案為:①加NaOH(s);②加Na2CO3(s);③加入活潑金屬(如鋅、鎂等).
點評 本題考查了弱電解質的電離,明確溶液導電能力的影響因素、弱電解質電離程度與溶液濃度的關系是解本題關鍵,正確分析圖象即可,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 1molNa2O2與SO2完全反應時轉移電子數為NA | |
| B. | 18g重水(D2O)所含的電子數為10NA | |
| C. | 0.5molNH4HSO4晶體中,含有H+數目約為0.5 NA | |
| D. | 常溫常壓下,3gHCHO和CH3COOH的混合物中含有0.4NA個原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 開始沉淀時的pH | 2.7 | - | - | - |
| 沉淀完全時的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4還原NO2至N2,則反應中放出的熱量一定為173.4 kJ | |
| D. | 若用標準狀況下2.24 L CH4還原NO2至N2,整個過程中轉移的電子為0.8mol |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省高二上第一次月考化學卷(解析版) 題型:選擇題
圖中的曲線表示的是其他條件一定時,反應:2NO+02 2N02 △H<0中N0的平衡轉化率與溫度的關系。圖中標有a、b、c、d四點,其中表示未達到平衡狀態,且v(正)﹤v(逆)的點是 ( )
2N02 △H<0中N0的平衡轉化率與溫度的關系。圖中標有a、b、c、d四點,其中表示未達到平衡狀態,且v(正)﹤v(逆)的點是 ( )
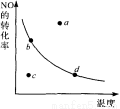
A.a點 B.b點 C. c點 D.d點
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | a、b、c最高價氧化物對應的水化物的酸性強弱關系是c>b>a | |
| B. | a、b、c的氫化物水溶液的酸性強弱關系是a<b<c | |
| C. | a和d的原子結合可以形成帶3個單位負電荷的陰離子 | |
| D. | 原子半徑由大到小的順序是c>b>d>a |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 實驗室常用以下方法制取氯氣:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答下列問題:
實驗室常用以下方法制取氯氣:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中1molMnO2被氧化轉移2mol電子 | |
| B. | 不溶于水的鹽(CaCO3、BaSO4等)都是弱電解質 | |
| C. | NaHSO4在熔融狀態下的電離方程式為:NaHSO4═Na++HSO4- | |
| D. | 需要通電才可進行的有:電解、電泳、電離、電鍍、電化腐蝕 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com