
(1)某一反應體系中有反應物和生成物共5種物質:S、H2S 、HNO3、NO 、H2O;則該反應中還原產物是_____;若反應過程中轉移了0.3mol電子,則氧化產物的質量是_____g。
(2)將a mol Cl2通入含b mol FeBr2的溶液中,當0< a / b≤1/2 時,反應的離子方程式為:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,寫出另2個可能發生的離子方程式。
①當 a / b =1時 ;
②當a / b≥3/2時 。
(3)觀察如下反應,總結規律,然后完成下列問題:
①Al(OH)3+H2O  Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
(Ⅰ)已知B(OH)3是一元弱酸,試寫出其電離方程式: ;
(Ⅱ)單質氰(CN)2是類鹵素,試寫出其與氫氧化鈉溶液反應的離子方程式 。
(1)NO(2分) , 4.8g (2分)
(2) ①2Cl2 + 2Fe2+ + 2Br― = 2Fe3+ + Br2 + 4Cl― (3分)
②3Cl2 + 2Fe2+ + 4Br― = 2Fe3+ + 2Br2 + 6Cl― (3分)
(3)(Ⅰ)B(OH)3+H2O  B(OH)4― + H+ (2分)
B(OH)4― + H+ (2分)
(Ⅱ)(CN)2 +2OH― = CN― + CNO― +H2O (2分)
解析試題分析:(1)硝酸的氧化性大于硫,所以在該反應中硝酸作氧化劑,在反應中得電子N化合價降低被還原,還原產物是NO,硫化氫在反應中失電子被氧化S化合價降低生成硫單質,所以該反應的方程式為:3H2S+2HNO3=3S+2NO+4H2O,當生成3molS時,反應轉移電子的物質的量是6mol,則若反應過程中轉移了0.3mol電子,則反應生成的S是0.15mol,所以質量為32g/mol×0.15mol=4.8g。
(2)FeBr2的溶液中,還原性Fe2+ >Br― ,所以通入氯氣,Fe2+ 先被氯氣氧化,反應完后再通氯氣,Br― 被氧化。所以當0< a / b≤1/2時,只有Fe2+ 被氧化,所以發生反應2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ;當 a / b =1時,Fe2+ 全部被氧化,Br― 是Fe2+ 的2倍,只有1半被氧化,所以發生的反應方程式為2Cl2 + 2Fe2+ + 2Br― = 2Fe3+ + Br2 + 4Cl― ;當a / b≥3/2時,Fe2+ 、Br―全部被氧化,所以反應為3Cl2 + 2Fe2+ + 4Br― = 2Fe3+ + 2Br2 + 6Cl―。
(3)因為B(OH)3是一元弱酸,所以類似氫氧化鋁(偏鋁酸)的電離:Al(OH)3+H2O  Al(OH)4-+ H+ ,所以B(OH)3 應該是與水作用,也生成酸根離子:B(OH)3+H2O
Al(OH)4-+ H+ ,所以B(OH)3 應該是與水作用,也生成酸根離子:B(OH)3+H2O  B(OH)4― + H+ ;單質氰(CN)2是類鹵素,其性質與鹵素單質類似,所以其與氫氧化鈉溶液反應也應該生成兩種鹽,把CN看成一個鹵素原子,則成鹽離子為CN-、CNO- ,所以離子方程式為:(CN)2 +2OH― = CN― + CNO― +H2O。
B(OH)4― + H+ ;單質氰(CN)2是類鹵素,其性質與鹵素單質類似,所以其與氫氧化鈉溶液反應也應該生成兩種鹽,把CN看成一個鹵素原子,則成鹽離子為CN-、CNO- ,所以離子方程式為:(CN)2 +2OH― = CN― + CNO― +H2O。
考點:本題考查的是氧化還原反應方程式配平與計算和弱電解質的電離。


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:填空題
亞氯酸鈉(NaClO2)常用于水的消毒和砂糖、油脂的漂白與殺菌。以下是用過氧化氫法生產亞氯酸鈉的工藝流程圖: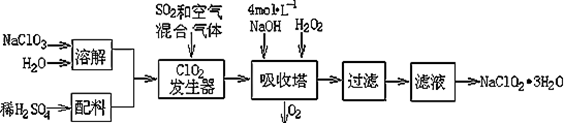
已知:①NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出NaClO2·3H2O ;
②Ksp(FeS)=6.3×10-18 ; Ksp(CuS)=6.3×10-36 ;Ksp(PbS)=2.4×10-28
(1)吸收塔內發生反應的離子方程式為 。該工藝流程中的NaClO3、ClO2、NaClO2都是強氧化劑,它們都能和濃鹽酸反應制取Cl2。若用二氧化氯和濃鹽酸制取Cl2,當生成5 mol Cl2時,通過還原反應制得氯氣的質量為 g。
(2)從濾液中得到NaClO2·3H2O晶體的所需操作依次是 (填寫序號)。
a蒸餾;b灼燒;c過濾;d冷卻結晶;e蒸發
(3)印染工業常用亞氯酸鈉(NaClO2)漂白織物,漂白織物時真正起作用的是HClO2。
下表是 25℃時HClO2及幾種常見弱酸的電離平衡常數:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol?L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10?8 K2=1.1×10?12 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
圍繞下列七種物質:①鋁,②A12O3,③稀硝酸,④H2SO4,⑤Ba(OH)2固體,⑥氨水,⑦A12(SO4)3,根據要求回答下列問題。
(1)既能與強酸反應,又能與強堿反應的是 (填序號)。
(2)屬于電解質的是 (填序號)。
(3)寫出最適宜制取Al(OH)3的離子方程式 。
(4)兩物質發生反應的離子方程式為H++OH—=H2O,請寫出該反應的化學方程式 。
(5)34.2g⑦溶于水配成500mL溶液,溶液中SO42—的物質的量濃度為 。
(6)①與③發生反應的化學方程式為A1+4HNO3=A1(NO3)3+NO↑+2H2O,該反應中還原劑與氧化劑的物質的量之比是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某混合溶液中可能大量含有的離子如下表所示:
| 陽離子 | H+、K+、Al3+、NH4+、Mg2+ |
| 陰離子 | Cl-、Br-、OH-、CO32-、AlO2- |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
今有一混合物的水溶液,只可能含有以下離子中的若干種:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-. 現取三份各100mL溶液進行如下實驗:
第一份加入AgNO3溶液有沉淀產生;
第二份加入足量NaOH溶液加熱后,收集到0.08mol氣體;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,經足量的鹽酸洗滌、干燥后,沉淀質量為4.66g。
根據上述實驗,回答以下問題:
(1)由第一份進行的實驗推斷該混合物是否一定含有Cl- : ,原因是 .
(2)由第二份進行的實驗可知混合物中應含有 離子,其物質的量濃度為 .
(3)由第三份進行的實驗可知12.54g 沉淀的成份為 。請計算形成該沉淀的原混合物中各離子的物質的量。(要求計算過程)
(4)綜合上述實驗,你認為以下結論正確的是
| A.該混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.該混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.該混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.該混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有下列物質:①氫氧化鈉固體 ②銅絲 ③鹽酸 ④熔融氯化鈉 ⑤二氧化碳氣體 ⑥氨水 ⑦蔗糖晶體。請用序號填空:
(1)上述狀態下可導電的是________。 (2)屬于電解質的是________。
(3)屬于非電解質的是________。 (4)上述狀態下的電解質不能導電的是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在Na+濃度為0.5mol/L的某澄清溶液中,還可能含有下表中的若干種離子: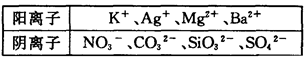
取該溶液100mL進行如下實驗(氣體體積在標準狀況下測定):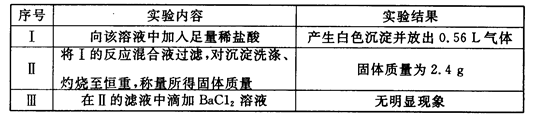
試回答下列問題:
(1)實驗Ⅰ能確定一定不存在的陽離子是____________。
(2)通過實驗Ⅰ、Ⅱ、Ⅲ和必要計算,填寫下表中陰離子的濃度(能計算出的,填寫計算結果,一定不存在的離子填“0”,不能確定是否存在的離子填“?”)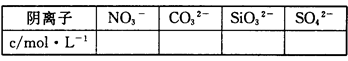
(3)判斷K+是否存在,若存在求其最小濃度,若不存在說明理由_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
I.(1)向Ba(OH)2溶液中加入稀硫酸,請完成下列問題:
(1)寫出反應的離子方程式:________________________________。
(2)下列三種情況下,離子方程式與(1)相同的是_________________。
A.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至顯中性
B.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至過量
Ⅱ.實驗室可以用氯酸鉀和濃鹽酸反應制取氯氣,反應式如下:KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O
(1)用雙線橋法表示上述反應中電子轉移的方向和數目。
(2)反應中發生氧化反應的物質是____________(填化學式),被還原的元素是____________________(填元素名稱)。
(3)氧化劑與還原劑的物質的量之比為____________________。
(4)若反應中被氧化的鹽酸為1mol,則生成的氯氣體積為_______________(標準狀況下)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二氧化氯(ClO2)是一種在水處理等方面有廣泛應用的高效安全消毒劑,而且與Cl2相比不會產生對人體有潛在危害的有機氯代物。制備ClO2有下列兩種方法:
方法一:2 NaClO3+4 HCl=2 ClO2↑+Cl2↑+2 NaCl+2 H2O
方法二:2 NaClO3+H2O2+H2SO4=2 ClO2↑+O2↑+2 Na2SO4+2 H2O
(1)方法一的離子方程式為 .
(2)方法二中被氧化的物質是 ,若反應中有0.1mol電子轉移,則產生的ClO2氣體在標準狀況下的體積為 L.
(3)用方法二制備的ClO2更適合用于飲用水的消毒,其主要原因是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com