
【題目】無水四氯化錫(SnCl4)常用作有機合成的氯化催化劑。實驗室可用熔融的錫(熔點231.9C)與Cl2 反應制備SnCl4裝置如下圖所示。
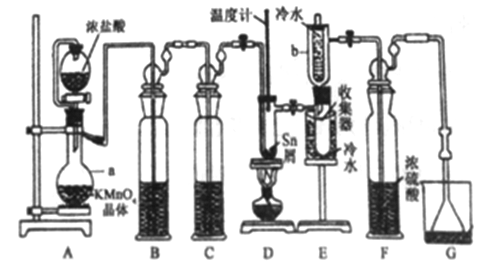
已知,① SnCl4在空氣中極易水解生成SnO2xH2O;②SnCl2、SnCl4有關物理性質如下表。
物質 | 顏色、狀態 | 熔點/℃ | 沸點/℃ |
SnCl2 | 無色晶體 | 246 | 652 |
SnCl4 | 無色液體 | -33 | 114 |
回答下列問題:
(1)儀器a的名稱是__________,其中發生反應的離子方程式為________。
(2)裝置B、C 中盛裝的試劑分別是_______、__________。
(3)當觀察到裝置F液面上方出現_____現象時才開始點燃酒精燈,待錫熔化后適當增大氯氣流量,繼續加熱。此時繼續加熱的目的有:①加快氯氣與錫反應,②__________。
(4)E裝置中b的作用是___________。
(5)若制得產品中含有少量Cl2,則可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量錫再加熱蒸餾
C.加入碘化鉀冷凝過濾 D.加入飽和食鹽水萃取
(6)可用滴定法測定最后產品的純度。準確稱取該樣品mg加入到適量濃鹽酸溶解,然后再加水稀釋至250 mL,用移液管移取25.00 ml,稀釋后的溶液于錐形瓶中,加入兩滴淀粉溶液作指示制,用cmol/L 的KIO3 標準溶液進行滴定,平行滴定3 次,平均消耗V mL的標準溶液。已知滴定時發生的反應為:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列問題:
①判斷達到滴定終點的現象為____________。
②產品中SnCl2(摩爾質量為M g/mol )的含量為____%(用含m、c、V、M 的代數式表示)。
【答案】 蒸餾燒瓶 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 飽和食鹽水 濃硫酸 黃綠色氣體時 使SnCl4氣化,利于從混合物中分離出來 冷凝回流SnCl4、導氣 B 當滴入最后一滴KIO3標準溶液時,錐形瓶中的溶液恰好由無色變為藍色,且半分鐘內不褪色 ![]()
【解析】考查實驗方案設計與評價,(1)根據儀器a的特點,儀器a為蒸餾燒瓶,裝置A的作用是制備氯氣,利用高錳酸鉀的強氧化性,把Cl-氧化成Cl2,即離子方程式為2MnO4-+ 16H+ + 10Cl-=2Mn2+ +5Cl2 ↑+8H2O;(2)裝置A中制備的氯氣中混有HCl和水蒸氣,對后續實驗產生干擾,必須除去,因此裝置B中盛放飽和食鹽水,裝置C中盛放濃硫酸;(3)點燃酒精燈之前,先通一段時間的氯氣,排除裝置中空氣,即F液面上方出現黃綠色氣體,再點燃酒精燈;裝置E的作用是收集SiCl4,因此裝置D的作用是制備SiCl4,繼續加熱的目的是①加快反應速率,②使SiCl4氣化,利于從混合物中分離出來;(4)E裝置中b的作用是冷凝回流SiCl4、導氣;(5)A、SiCl4極易水解,因此不能用NaOH溶液,除去SiCl4的氯氣,故A錯誤;B、加入足量的錫與氯氣反應,生成SnCl2,根據表格中數據,再加熱蒸餾,故B正確;C、加入的碘化鉀與氯氣反應,生成I2和KCl,產品中混有I2,故C錯誤;D、加入飽和食鹽水,不能吸收Cl2,故D錯誤;(6)①根據滴定時的反應,I2能與Sn2+發生反應生成Sn4+和I-,滴定到終點的現象:當滴入最后一滴KIO3標準液時,錐形瓶中的溶液由無色變為藍色,且30s或半分鐘不褪色;②根據得失電子數目守恒,V×10-3×c×6=n(Sn2+)×2,解得n(Sn2+)=3Vc×10-3mol,250mL溶液中n(Sn2+)=3×10-2Vcmol,即SnCl2的含量為![]() %。
%。


 課課練江蘇系列答案
課課練江蘇系列答案 名牌中學課時作業系列答案
名牌中學課時作業系列答案科目:高中化學 來源: 題型:
【題目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六種粒子,屬于同一氧化還原反應中的反應物和生成物,下列敘述不正確的是
六種粒子,屬于同一氧化還原反應中的反應物和生成物,下列敘述不正確的是
A.被氧化和被還原的離子數目比為![]()
B.該反應說明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 發生氧化反應,轉移
發生氧化反應,轉移![]()
D.若利用該反應設計原電池,則負極反應為:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某Al2(SO4)3溶液V mL中含有Al3+a g,取出V/4 mL溶液稀釋成V mL后,SO42― 離子的物質的量濃度為 (用含a、V的代數式表示,化簡到最簡整數比)
(2)標準狀況下,密度為0.75 g/L的C2H4與CH4組成的混合氣體中,C2H4的體積分數約為 。(保留三位有效數字)
(3)標準狀況下,將V L A氣體(摩爾質量為M g/mol)溶于0.3 L水中,所得溶液密度為ρ g/mL,則此溶液物質的量濃度為 。(用含ρ、V 、M的代數式表示,化簡到最簡整數比)
(4)一定溫度下,將a molSO3氣體通入體積為V L的密閉容器中發生如下反應:2SO3=2SO2+O2,一段時間之后測得生成氧氣的物質的量為b mol(2b<a),則這段時間內,反應前后氣體的壓強比為 ,反應前后氣體的密度比為 ,反應后氣體的平均相對分子質量為 。(化簡到最簡整數比)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成藥物X、Y和高聚物Z,可以用烴A為主要原料,采用以下路線:
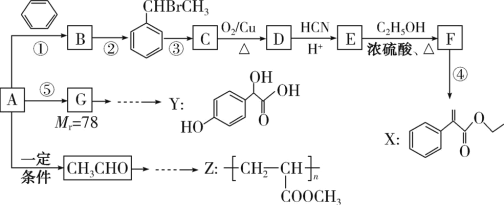
已知:I.反應①、反應②均為加成反應
II. 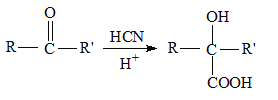 (R和R' 可以是烴基或H原子)請回答下列問題:
(R和R' 可以是烴基或H原子)請回答下列問題:
(1)CH3CHO分子中碳原子的雜化方式為_______________,CH3CH2OH的沸點明顯高于CH3CHO的原因是________________________。
(2)A的名稱為________________,X的分子式為________________________。
(3)關于藥物Y(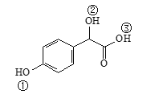 )中①、②、③ 3個-OH的酸性由弱到強的順序是____________________。
)中①、②、③ 3個-OH的酸性由弱到強的順序是____________________。
(4)寫出反應C→D的化學方程式:___________。E→F的化學方程式: ____________。
(5)參考上述流程以CH3CHO和CH3OH為起始原料,其它無機試劑任選設計合成Z的路線流程圖:_____________________。合成路線流程圖示例:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CH2Br
CH3CH2Br
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機反應的化學方程式書寫正確是
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.![]()
C.CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+ H2O
CH3COOCH2CH3+ H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室欲使用 500 mL 0.2 molL -1 CuSO4 溶液,配制該溶液包含以下步驟:
①稱取一定質量膽礬(CuSO45H2O)、放入燒杯,用適量蒸餾水將其完全溶解;
②把溶液小心地注入容量瓶中;
③繼續向容量瓶中加蒸餾水至凹液面距刻度線1~2cm 時,改用膠頭滴管滴加,直到溶液的凹液面恰好與刻度線相切為止;
④用少量蒸餾水洗滌燒杯和玻璃棒2~3 次,每次洗滌液都轉入容量瓶,并輕輕搖勻;
⑤將容量瓶塞好,充分搖勻。
請填寫下列空白:
(1)應該稱取膽礬的質量是_________。
(2)上述操作的正確順序是_________。
(3)實驗用到的儀器有托盤天平(砝碼)、藥匙、燒杯、玻璃棒__________等,玻璃棒的作用是_________。
(4)下列情況中會導致所配溶液濃度偏小的是 _________(填序號)。
a.容量瓶使用前未干燥
b.轉移溶液后,燒杯沒有洗滌
c.定容過程觀察容量瓶內液面時,俯視刻度線
d.顛倒搖勻后,發現液面低于刻度線,不作任何處置
e.加蒸餾水時不慎超過刻度線,用膠頭滴管小心地吸去超出部分,使凹液面底部與刻度線相切
(5)取 100 mL 所配溶液,向其中加入 1.68 g 鐵粉,充分反應后,過濾,將固體洗滌、干燥后,再加入 1 molL-1 稀硫酸至固體不再溶解。試計算:
①至少需要稀硫酸 _________mL。
②固體溶解過程中產生氫氣_________mL(標準狀況)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N、S是重要的非金屬元素,按要求回答下列問題:
(1)煙道氣中含有的CO和SO2是重要的污染物,可在催化劑作用下將它們轉化為S(s)和CO2,此反應的熱化學方程式為______________________________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1。
(2)向甲、乙兩個均為1 L的密閉容器中,分別充入5 mol SO2和3 mol O2,發生反應:2SO2(g)+
O2(g)![]() 2SO3(g) ΔH<0。甲容器在溫度為T1的條件下反應,達到平衡時SO3的物質的量為4.5 mol;乙容器在溫度為T2的條件下反應,達到平衡時SO3的物質的量為4.6 mol。則T1___T2(填“>”、“<”),甲容器中反應的平衡常數K=_____________________。
2SO3(g) ΔH<0。甲容器在溫度為T1的條件下反應,達到平衡時SO3的物質的量為4.5 mol;乙容器在溫度為T2的條件下反應,達到平衡時SO3的物質的量為4.6 mol。則T1___T2(填“>”、“<”),甲容器中反應的平衡常數K=_____________________。
(3)如圖所示,A是恒容的密閉容器,B是一個體積可變的充氣氣囊。保持恒溫,關閉K2,分別將1 mol N2和3 mol H2通過K1、K3充入A、B中,發生的反應為:N2(g)+3H2(g) ![]() 2NH3(g),起始時A、B的體積相同均為a L。
2NH3(g),起始時A、B的體積相同均為a L。
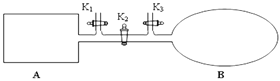
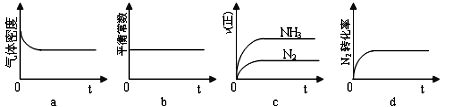
①下列示意圖既能說明A容器中反應達到平衡狀態,又能說明B容器中反應達到平衡狀態的是______。
②容器A中反應到達平衡時所需時間t s,達到平衡后容器的壓強變為原來的5/6,則平均反應速率υ(H2)=___________________________。
(4)將0.1 mol氨氣分別通入1 L pH=1的鹽酸、硫酸和醋酸溶液中,完全反應后三溶液中NH4+離子濃度分別為c1、c2、c3,則三者濃度大小的關系為____________(用“c1、c2、c3和>、<、=”表示)。已知醋酸銨溶液呈中性,常溫下CH3COOH的Ka=1×10-5 mol·L-1,求該溫度下NH4Cl的水解常數K h 為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用已知濃度的NaOH溶液滴定某濃度的弱酸 HA,其滴定曲線如圖所示,下列說法正確的是
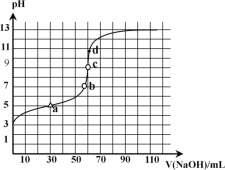
A.滴定時,可用酚酞作指示劑
B.a點表示反應終點
C.在b點時:c(Na+)=c(A-)
D.在c點時:c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫、氯、氮是三種常見的非金屬元素。
完成下列填空:
(1)我們祖先的四大發明之一黑火藥的爆炸反應為:S+2KNO3+3C A+N2↑+3CO2↑(已配平)。氮原子核外電子排布式為______________,生成物固體 A屬于_____晶體。
(2)工業合成氨可以實現大規模固氮,氨可用于生產氯化銨、硫酸銨等化學肥料,等物質的量濃度的兩溶液相同溫度下pH大小為:氯化銨___________硫酸銨(選填>、=或<)。
(3)工業上在催化劑條件下,用NH3作為還原劑將煙氣中的NO2還原成無害的氮氣和水,反應方程式可表示為:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g),用單線橋標出該反應電子轉移的方向和數目______,若該反應氧化產物比還原產物多0.1mol,被吸收的NO2在標準狀況下的體積為_________。
7N2(g)+12H2O(g),用單線橋標出該反應電子轉移的方向和數目______,若該反應氧化產物比還原產物多0.1mol,被吸收的NO2在標準狀況下的體積為_________。
(4)氯水成分的多樣性決定了其性質的復雜性,氯氣可用作自來水生產過程中的消毒劑,寫出其中主要的化學反應方程式______________________________,在硝酸銀溶液中滴加氯水,可以看到有白色沉淀產生,起作用的微粒是___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com