
【題目】下列事實不能用勒夏特列原理(平衡移動原理)解釋的是
①鐵在潮濕的空氣中容易生銹
②二氧化氮與四氧化氮的平衡體系,加壓縮小體積后顏色加深
③實驗室可用排飽和食鹽水的方法收集氯氣
④鈉與氯化鉀共融制備鉀 Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑤開啟啤酒瓶后,瓶中馬上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
【答案】B
【解析】
①鐵在潮濕的空氣中生銹是因為發生了電化學腐蝕,與平衡移動無關;②二氧化氮與四氧化氮的平衡體系,加壓縮小體積后顏色加深,是因為二氧化氮濃度的增加,并不是因平衡移動導致;③氯氣溶于水存在平衡:Cl2+H2O![]() H++Cl-+HClO,而飽和食鹽水中氯離子濃度達到飽和,氯離子濃度增大,平衡逆向移動,故不能再溶解氯氣,因此實驗室可用排飽和食鹽水的方法收集氯氣,能用勒夏特列原理解釋;④鈉與氯化鉀共融制備Na(l)+KCl(l)
H++Cl-+HClO,而飽和食鹽水中氯離子濃度達到飽和,氯離子濃度增大,平衡逆向移動,故不能再溶解氯氣,因此實驗室可用排飽和食鹽水的方法收集氯氣,能用勒夏特列原理解釋;④鈉與氯化鉀共融制備Na(l)+KCl(l)![]() K(g)+NaCl(l) ,因反應條件為高溫,生成物中K(g)揮發,使生成物濃度降低,平衡右移,能用勒夏特列原理解釋;⑤啤酒中因有二氧化碳和水反應生成的碳酸,開啟啤酒瓶后,壓強降低,碳酸分解為二氧化碳和水,二氧化碳放出,瓶中馬上泛起大量泡沫,能用勒夏特列原理解釋;故答案為:①②,選B。
K(g)+NaCl(l) ,因反應條件為高溫,生成物中K(g)揮發,使生成物濃度降低,平衡右移,能用勒夏特列原理解釋;⑤啤酒中因有二氧化碳和水反應生成的碳酸,開啟啤酒瓶后,壓強降低,碳酸分解為二氧化碳和水,二氧化碳放出,瓶中馬上泛起大量泡沫,能用勒夏特列原理解釋;故答案為:①②,選B。


 期末100分闖關海淀考王系列答案
期末100分闖關海淀考王系列答案 小學能力測試卷系列答案
小學能力測試卷系列答案科目:高中化學 來源: 題型:
【題目】一種從銅電解工藝的陽極泥中提取Se和Te的流程如下:

下列敘述錯誤的是( )
A. 合理處理陽極泥有利于保護環境和資源再利用
B. 流出液是H2SO4溶液
C. 電解過程中陰極上析出單質Te
D. “焙砂”與碳酸鈉充分混合后,可在瓷坩鍋中焙燒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是
2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是

A. ①壓強對反應的影響(p2>p1) B. ②溫度對反應的影響
C. ③平衡體系增加N2對反應的影響 D. ④催化劑對反應的影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組為探究銅跟濃硫酸的反應,用如圖裝置進行有關實驗。請回答:
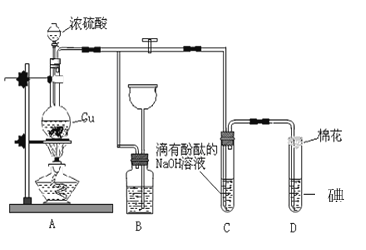
(1)裝置A中發生的化學反應的化學方程式: _________________________________。
(2)裝置B 的作用是__________________,B中廣口瓶內應盛放的液體是_________(填序號)
①水 ②澄清石灰水
③Na2CO3溶液 ④飽和的NaHSO3 溶液
(3)裝置C和D 中產生的現象相同,但原因卻不同。C中反應的方程式:_______________________________________,而D 中則是由于SO2 具有_______性,D中反應的方程式:________________________。
(4)實驗中,0.1molCu與含0.2mol硫酸的溶液反應后,銅和硫酸都有剩余。 可以證明有余酸的實驗方案是___________
A.可再加入鋅粒 B.可再加入氯化鋇溶液
C.再加入銀粉 D.再滴入碳酸氫鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知熱化學方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反應,最終放出的熱量為
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反應,最終放出的熱量為
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤是重要的化工原料,用煤作燃料不僅浪費,而且因煙煤中含有硫的化合物(FeS2)燃燒時生成SO2氣體造成環境污染。假設一個具有3萬戶人口的小型城市,平均每戶燃煤5kg,這種煤含FeS25%,在燃燒時如有90%的S轉化為SO2,并被排入大氣中,試計算:
(1)該城市僅居民作燃料用煤一年(365天)向大氣中排放SO2的總質量達多少噸?______
(2)假如這些SO2全部能回收,可生產98%的H2SO4多少噸?____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含氮化合物在生產、生命活動中有重要的作用。回答下列問題:
(1)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,H2O(1)=H2O(g)△H3=+ckJ/mol,寫出在298K時,氨氣燃燒生成N2的熱化學方程式___________。
(2)肌肉中的肌紅蛋白(Mb)可與O2結合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分別表示正反應和逆反應的速率常數,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃時測得肌紅蛋白的結合度(α)與P(O2)的關系如下表[結合度(α)指已與O2結合的肌紅蛋白占總肌紅蛋白的百分比]:
MbO2(aq),其中k正和k逆分別表示正反應和逆反應的速率常數,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃時測得肌紅蛋白的結合度(α)與P(O2)的關系如下表[結合度(α)指已與O2結合的肌紅蛋白占總肌紅蛋白的百分比]:
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
①計算37℃、P(O2)為2.00kPa時,上述反應的平衡常數K=___________。
②導出平衡時肌紅蛋白與O2的結合度(α)與O2的壓強[P(O2)]之間的關系式α=___________(用含有k正、k逆的式子表示)。
(3)構成肌紅蛋白的甘氨酸(NH2CH2COOH)是一種兩性物質,在溶液中以三種離子形式存在,其轉化關系如下:
![]()
![]()
![]()
![]()
![]()
在甘氨酸溶液中加入酸或堿,三種離子的百分含量與![]() 的關系如圖所示:
的關系如圖所示:

①純甘氨酸溶液呈___________性;當溶液呈中性時三種離子的濃度由大到小的順序為___________。
②向![]() =8的溶液中加入過量HCl時,反應的離子方程式為___________。
=8的溶液中加入過量HCl時,反應的離子方程式為___________。
③用電位滴定法可測定某甘氨酸樣品的純度.

稱取樣品150mg,在一定條件下,用0.1000mol/L的高氯酸溶液滴定(與甘氨酸1︰1發生反應),測得電壓變化與滴入HClO4溶液的體積關系如下圖。做空白對照實驗,消耗HClO4溶液的體積為0.25mL,該樣品的純度為___________%(計算結果保留一位小數)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖為某化學反應速率一時間圖。在t1時刻升高溫度或增大壓強,都符合圖所示變化的反應是

A. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
B. 2SO2(g)+O2(g)![]() 2SO3(g)ΔH< 0
2SO3(g)ΔH< 0
C. H2(g)+I2(g)![]() 2HI(g)ΔH>0
2HI(g)ΔH>0
D. C(s)+H2O(g)![]() CO(g)+H2(g)ΔH>0
CO(g)+H2(g)ΔH>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯堿廠電解飽和食鹽水制取NaOH的工藝流程示意圖如下:

依據上圖,完成下列填空:
(1)在電解過程中,所發生的反應方程式為______________________________________。與電源_______極相連的電極附近溶液滴入酚酞顯紅色。陽極產物是______________,實驗室用__________________________檢驗該物質。
(2)如果粗鹽中SO42含量較高,必須添加鋇試劑除去SO42,該試劑可以是_____________________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 d.BaCO3
(3)為有效除去Ca2+、Mg2+、SO42,加入試劑的合理順序為__________________。
a.先加NaOH,后加Na2CO3,再加鋇試劑
b.先加NaOH,后加鋇試劑,再加Na2CO3
c.先加鋇試劑,后加NaOH,再加Na2CO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com