
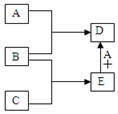
 已知A、B、C、D、E均為中學化學中常見物質,在一定條件下相互轉化關系如圖所示(反應條件和部分產物已省略).
已知A、B、C、D、E均為中學化學中常見物質,在一定條件下相互轉化關系如圖所示(反應條件和部分產物已省略).分析 A、B、C、D、E均為中學化學中常見物質,
①A常溫下為黃綠色的氣體單質,則A為Cl2;
②B為一種常見變價金屬單質,在冷的濃硫酸中會被鈍化,為Fe;
A和B反應生成D為FeCl3;
③C的水溶液是一種無氧酸,且C的組成中含有與A相同的元素,C能和Fe反應生成E,E和氯氣反應生成D,所以C為HCl、E為FeCl2,再結合題目分析解答.
解答 解:A、B、C、D、E均為中學化學中常見物質,
①A常溫下為黃綠色的氣體單質,則A為Cl2;
②B為一種常見變價金屬單質,在冷的濃硫酸中會被鈍化,為Fe;
A和B反應生成D為FeCl3;
③C的水溶液是一種無氧酸,且C的組成中含有與A相同的元素,C能和Fe反應生成E,E和氯氣反應生成D,所以C為HCl、E為FeCl2,
(1)A的名稱為氯氣,構成非金屬單質A的元素的最高價氧化物中O為-2價、Cl元素化合價為+7價,所以該分子式為Cl2O7,故答案為:氯氣;Cl2O7;
(2)氯氣和水反應生成強電解質HCl、弱電解質HClO,且該反應是可逆反應,則A與水反應的離子方程式為Cl2+H2O?H++Cl-+HClO,
故答案為:Cl2+H2O?H++Cl-+HClO;
(3)氯化亞鐵和氯氣發生氧化還原反應生成氯化鐵,所以A與E反應生成D的化學方程式為2FeCl2+Cl2=2FeCl3,
故答案為:2FeCl2+Cl2=2FeCl3;
(4)E是氯化亞鐵,氯化亞鐵和NaOH反應先生成白色沉淀氫氧化亞鐵,立即轉化為灰綠色,最終生成紅褐色氫氧化鐵沉淀,所以看到的現象是:先生成白色沉淀、立即轉化為灰綠色、最終生成紅褐色沉淀,
故答案為:先生成白色沉淀、立即轉化為灰綠色、最終生成紅褐色沉淀.
點評 本題以鐵及其化合物之間的轉化為載體考查無機物推斷,側重考查學生分析推斷能力,明確常見物質的特殊性質及特殊顏色是解本題關鍵,以氯氣顏色、變價金屬為題眼進行推斷,題目難度不大.


 浙大優學小學年級銜接導與練浙江大學出版社系列答案
浙大優學小學年級銜接導與練浙江大學出版社系列答案 小學暑假作業東南大學出版社系列答案
小學暑假作業東南大學出版社系列答案 津橋教育暑假拔高銜接廣東人民出版社系列答案
津橋教育暑假拔高銜接廣東人民出版社系列答案 波波熊暑假作業江西人民出版社系列答案
波波熊暑假作業江西人民出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 盡可能使用稀溶液 | B. | 選擇合適的催化劑 | ||
| C. | 碾細固體反應物 | D. | 提高反應體系的溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 藥名 | 胃舒平 | 達喜 |
| 有效成分的化學式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相對分子質量 | 78 | 530 |
| 每片含有效成份的藥量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 編號 | 0.1mol/L H2C2O4 溶液的體積/mL | 0.01mol/L 酸性 KMnO4 的體積/mL | 蒸餾水的體積/mL | 溫度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
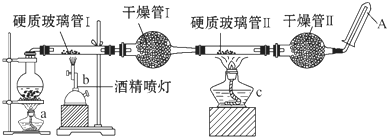 在常溫下,Fe與水并不起反應,但在高溫下,Fe可與水蒸氣發生反應.應用下列裝置,試探究反應的部分產物.在硬質玻璃管Ⅰ中放入還原鐵粉和石棉絨的混合物,硬質玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛裝的物質是無水硫酸銅和石棉絨的混合物
在常溫下,Fe與水并不起反應,但在高溫下,Fe可與水蒸氣發生反應.應用下列裝置,試探究反應的部分產物.在硬質玻璃管Ⅰ中放入還原鐵粉和石棉絨的混合物,硬質玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛裝的物質是無水硫酸銅和石棉絨的混合物查看答案和解析>>
科目:高中化學 來源: 題型:解答題
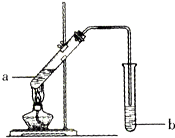 如圖為實驗室制備乙酸乙醋的裝置.
如圖為實驗室制備乙酸乙醋的裝置.| 物質 | 熔點/℃ | 沸點/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 濃H2SO4 | 338 | 1.84 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com