
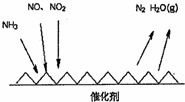
 隨著我國工業化水平的不斷發展,解決水、空氣污染問題成為重要課題.
隨著我國工業化水平的不斷發展,解決水、空氣污染問題成為重要課題.分析 (1)①得電子,化合價降低的反應物是氧化劑;
②根據化合價升降總數相等、原子守恒來配平;
(2)①亞鐵離子會和Cr2O72-的酸性廢水反應,發生反應的離子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,結合電極方程式Fe-2e-═Fe2+計算;
②根據溶度積計算;
(3)①加入一定量 Na2S2O3 溶液,發生反應2S2O32-+I2═S4O62-+2I-,使I2還原為I-;
②由圖示表明,pH至1~3時,ClO2-將I-氧化生成的I2與淀粉結合再次出現藍色,根據化合價升降總數相等、原子守恒和電荷守恒來配平;
③根據關系式ClO2~I-~S2O32-先計算出ClO2的物質的量,然后再計算出濃度;
解答 解:(1)①由圖甲可知SCR技術中NH3與NO、NO2反應產物為N2和水,故氧化劑為NO、NO2,
故答案為:NO、NO2;
②NH3中氮的化合價由-3價升高到0價,一個NH3失去3個電子,NO2中氮的化合價由+4價降低到0價,一個NO2得到4個電子,NO中氮的化合價由+2價降低到0價,一個NO得到2個電子,當NO2與NO的物質的量之比為1:1時,轉移電子的最小公倍數為6,結合質量守恒可知方程式為:2NH3+NO+NO2$\frac{\underline{\;Fe\;}}{△}$2N2+3H2O,
故答案為:2NH3+NO+NO2$\frac{\underline{\;Fe\;}}{△}$2N2+3H2O;
(2)①亞鐵離子會和Cr2O72-的酸性廢水反應,發生反應的離子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,陽極電極方程式Fe-2e-═Fe2+,則
Cr2O72-~6Fe2+~12mol電子,1mol Cr2O72-完全生成Cr(0H)3沉淀,外電路通過電子的物質的量為12mol,
故答案為:12;
②溶液的pH=6,則c(OH-)=10-8mol•L-1,則c3(OH-)×c(Cr3+)=Ksp=10-32,c(Cr3+)=10-8mol•L-1<10-5mol•L-1,能直接排放,
故答案為:能;
(3)①加入一定量 Na2S2O3 溶液,發生反應為:2S2O32-+I2═S4O62-+2I-,使I2還原為I-,故藍色會消失,
故答案為:藍色消失,半分鐘內不變色;
②由圖示表明,pH至1~3時,ClO2-將I-氧化生成的I2,ClO2-中氯的化合價由+3價降低到-1價,一個ClO2-得到4個電子,碘的化合價由-1價升高到0價,一個I-失去1個電子,轉移電子的最小公倍數為4,結合質量守恒、電荷守恒可知離子方程式為:ClO2-+4I-+4H+$\frac{\underline{\;通電\;}}{\;}$Cl-+2I2+2H2O;
故答案為:ClO2-+4I-+4H+$\frac{\underline{\;通電\;}}{\;}$Cl-+2I2+2H2O;
③ClO2 ~I-~S2O32-
1 1
1.0×10-5mol 1.0×10-3 mol/L×0.01L
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水樣的體積為1.0L,所以 ClO2 的濃度為$\frac{0.675mg}{1L}$=0.675 mg•L-1,
故答案為:0.675.
點評 本題主要考查了氧化還原反應、離子方程式式的書寫以及化學計算,難度中等,注意掌握實驗原理和電子得失配平的方法.


 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D都是元素周期表中前36號的元素,它們的原子序數依次增大.A與其他3種元素既不在同一周期又不在同一主族.B原子的L層p軌道中有5個電子;C是周期表中1-18列中的第14列元素;D原子的L層電子數與最外層電子數之比為4:1,其d軌道中有一對成對電子.請回答:
已知A、B、C、D都是元素周期表中前36號的元素,它們的原子序數依次增大.A與其他3種元素既不在同一周期又不在同一主族.B原子的L層p軌道中有5個電子;C是周期表中1-18列中的第14列元素;D原子的L層電子數與最外層電子數之比為4:1,其d軌道中有一對成對電子.請回答: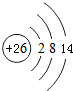 ,它的+3價離子的電子排布式為1s22s22p63s2sp5.
,它的+3價離子的電子排布式為1s22s22p63s2sp5.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 命名為:3,3-二甲基-1-戊烯;寫出該物質與HBr反應的化學方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
命名為:3,3-二甲基-1-戊烯;寫出該物質與HBr反應的化學方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3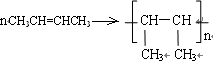
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 實驗室里要配制465mL 0.2mol/L的硫酸鈉溶液.
實驗室里要配制465mL 0.2mol/L的硫酸鈉溶液.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
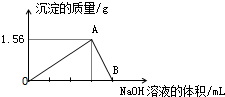 向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液時,得到Al(OH)3沉淀的質量與所滴加NaOH溶液的體積(mL)關系如圖所示,試回答下列問題:
向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液時,得到Al(OH)3沉淀的質量與所滴加NaOH溶液的體積(mL)關系如圖所示,試回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com