
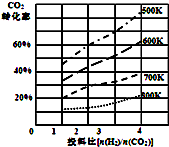
 將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3OCH3(g)+3H2O(l)
將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3OCH3(g)+3H2O(l)分析 (1)根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積進行計算;
(2)①根據溫度對平衡的影響分析△H的符號;
②平衡常數K只與溫度有關;
③由圖可知,在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2時,二氧化碳轉化率為30%,令CO2、H2的起始物質的量分別為1mol、2mol,轉化的二氧化碳為0.3mol,根據方程式可知轉化的氫氣為0.9mol,進而計算H2 的轉化率;
(3)當可逆反應達到平衡狀態時,正逆反應速率相等,反應體現中各物質的物質的量、物質的量濃度及百分含量都不變,以及由此引起的一些物理量不變,據此分析解答;
解答 解:(1)平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積,所以平衡常數K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$,故答案為:$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
(2)①因為溫度越高,CO2轉化率越小,則平衡逆移,所以該反應正方向為放熱反應,即△H<0,故答案為:<;
②K只受溫度影響,若溫度不變,減小投料比,則K不變,
故答案為:不變;
③由圖可知,在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2時,二氧化碳轉化率為30%,令CO2、H2的起始物質的量分別為1mol、2mol,轉化的二氧化碳為0.3mol,根據方程式可知轉化的氫氣為0.9mol,進而計算H2 的轉化率=$\frac{0.9mol}{2mol}$×100%=45%,
故答案為:45%;
(3)A.二氧化碳的濃度不變,則達到了平衡,故A選;
B.反應前后氣體的系數和不相等,當容器內壓強不再改變,則達到了平衡,故B選;
C.該反應是一個反應前后氣體體積變化的可逆反應,容器的體積不變,但反應前后氣體質量變化,氣體的密度不發生變化,則達到了平衡,故C選;
D.任何時候CH3OCH3與H2O的物質的量之比不變,不能說明反應達到平衡,故D不選;
故答案為:ABC.
點評 本題考查了化學平衡計算、影響平衡的因素分析、平衡常數和轉化率計算等知識點,主要是圖象的理解應用,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗現象 | 結論 |
| A | 將“84”消毒液(含NaClO)滴入品紅溶液中,褪色緩慢,若同時加入食醋 | 紅色很快褪為無色 | 隨溶液pH減小,NaClO的氧化能力增強 |
| B | 向某氯化亞鐵溶液中加入Na2O2粉末 | 出現紅褐色沉淀 | 說明原氯化亞鐵已氧化變質 |
| C | 苯酚和水的濁液中,加Na2CO3溶液 | 溶液變澄清 | 苯酚的酸性比碳酸強 |
| D | 向溶液X中加入NaHCO3粉末 | 產生無色氣體 | 溶液X的溶質一定屬于酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 以極性鍵結合起來的分子一定是極性分子 | |
| B. | 非極性分子中,一定含有非極性共價鍵 | |
| C. | 乙醇分子和水分子間只存在范德華力 | |
| D. | 鹵素單質按F2→I2,熔沸點逐漸升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 恒容密閉容器中進行的反應3A(g)?B(g)+c(g),在其他條件不變的情況下,再充入一定量的A氣體,A的轉化率將增大 | |
| B. | 對于可逆反應N2(g)+3H2(g)?2NH3(g),增大氮氣濃度可增加活化分子百分數,從而使反應速率增加 | |
| C. | 將FeCl3溶液和NaAlO2溶液相混,所得固體產物Fe(OH)3 | |
| D. | 反應NH3(g)+HCl(g)?NH4Cl(s)△H<O在任何條件下均能自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶解度(s) | B. | 物質的量濃度(c) | C. | 質量分數(w) | D. | 摩爾質量(M) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com