
【題目】以食鹽為原料進行生產并綜合利用的某些過程如圖1所示. 
(1)除去粗鹽中的Ca2+、Mg2+和SO42﹣離子,加入下列沉淀劑的順序是(填序號) .
a.Na2CO3 b.NaOH c.BaCl2
(2)將濾液的pH調至酸性除去的離子是 .
(3)圖2表示電解飽和NaCl溶液的裝置,X、Y是石墨棒.實驗開始時,在兩邊同時各滴入幾滴酚酞溶液,請回答以下問題:X極上的電極反應式是 , 在X極附近觀察到的現象是;Y電極上的電極反應式是 , 檢驗該電極反應產物的方法是 . 電解NaCl溶液的離子方程式是 .
(4)若向分離出NaHCO3晶體后的母液中加入過量生石灰,則可獲得一種可以循環使用的氣體,其化學式是 .
(5)常溫下,向某pH=11的Na2CO3溶液中加入過量石灰乳,過濾后所得溶液pH=13,則反應前的溶液中與反應后的濾液中水電離出的c(OH﹣)的比值是 .
【答案】
(1)cab或者cba或者bca
(2)OH﹣、CO32﹣
(3)2H++2e﹣=H2↑;有無色氣泡產生,溶液變紅;2Cl﹣﹣2e﹣=Cl2↑;將濕潤的KI淀粉試紙放在氣體出口,若觀察到試紙變藍,證明有Cl2產生;2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑
2OH﹣+H2↑+Cl2↑
(4)NH3
(5)1×1010
【解析】解:(1.)加入氫氧化鈉溶液時,能和氯化鎂反應生成氫氧化鎂沉淀和氯化鈉,從而除去氯化鎂;加入氯化鋇時,能和硫酸鈉反應生成硫酸鋇沉淀和氯化鈉,從而除去硫酸鈉;加入碳酸鈉溶液時,能和氯化鈣、過量的氯化鋇反應生成碳酸鈣沉淀、碳酸鋇沉淀和氯化鈉,從而除去氯化鈣和過量的氯化鋇;過濾,向濾液中加入適量的稀鹽酸時,可以把過量的氫氧化鈉和碳酸鈉除去.以此類推,如果依次加入氯化鋇溶液、氫氧化鈉溶液、碳酸鈉溶液或依次加入氯化鋇溶液、碳酸鈉溶液、氫氧化鈉溶液,可以達到同樣的目的,所以答案是:cab或者cba或者bca;
(2.)稀鹽酸能和氫氧化鈉、碳酸鈉反應,蒸發時可以得到氯化鈉的飽和溶液,將濾液的pH調至酸性除去的離子是OH﹣、CO32﹣ , 所以答案是:OH﹣、CO32﹣;
(3.)和電源的負極相連的是電解池的陰極,該電極上的電極反應為:2H++2e﹣=H2↑,氫離子濃度減小,所以堿性增強,酚酞變紅,和電源的正極相連的是陽極,該機反應式為:2Cl﹣﹣2e﹣=Cl2↑,檢驗氯氣的方法為:將濕潤的KI淀粉試紙放在氣體出口,若觀察到試紙變藍,證明有Cl2產生,根據兩極上的電極反應可以得到總反應為:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑,所以答案是:2H++2e﹣=H2↑;有無色氣泡產生,溶液變紅;2Cl﹣﹣2e﹣=Cl2↑;將濕潤的KI淀粉試紙放在氣體出口,若觀察到試紙變藍,證明有Cl2產生;2Cl﹣+2H2O
2OH﹣+H2↑+Cl2↑,所以答案是:2H++2e﹣=H2↑;有無色氣泡產生,溶液變紅;2Cl﹣﹣2e﹣=Cl2↑;將濕潤的KI淀粉試紙放在氣體出口,若觀察到試紙變藍,證明有Cl2產生;2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;
2OH﹣+H2↑+Cl2↑;
(4.)分離出NaHCO3晶體后的母液中含有氯化銨,加入過量生石灰后,氧化鈣和水反應生成氫氧化鈣,氫氧化鈣和氯化銨反應能生成氯化鈣、水和氨氣,氨氣可以循環使用,化學式是NH3 , 所以答案是:NH3;
(5.)pH為11碳酸鈉溶液中:C(H+)剩余C(OH﹣)水=10﹣14;C(OH﹣)水=10﹣3mol/L,Na2CO3溶液中加入過量石灰乳,反應生成碳酸鈣和氫氧化鈉,所得溶液pH=13,則此時水電離出的c(OH﹣)的值是10﹣13mol/L,所以反應前的溶液中與反應后的濾液中水電離出的c(OH﹣)的比值是 ![]() =1×1010 , 所以答案是:1×1010 .
=1×1010 , 所以答案是:1×1010 .


科目:高中化學 來源: 題型:
【題目】利用反應6NO2+8NH3═7N2+12H2O構成電池的方法,既能實現有效消除氮氧化物的排放,減輕環境污染,又能充分利用化學能,裝置如圖所示.下列說法不正確的是( ) 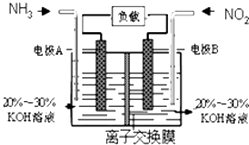
A.電流從右側電極經過負載后流向左側電極
B.為使電池持續放電,離子交換膜需選用陰離子交換膜
C.電極A極反應式為:2NH3﹣6e﹣=N2+6H+
D.當有4.48L NO2(標準狀況) 被處理時,轉移電子為0.8mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】描述下列反應的現象并寫出反應的離子方程式。
(1)向FeCl3溶液中滴加NaOH溶液,現象:__________________,離子方程式:____________________
(2)向NaHCO3溶液中滴加稀H2SO4,現象:__________________,離子方程式:__________________
(3)稀HNO3和Ba(OH)2溶液混合,現象:__________________,離子方程式:____________________
(4)比較:上述三個離子反應發生的條件的不同點是______________________;相同點是________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇和水,并開發出以甲醇為燃料的燃料電池.已知圖甲池為甲醇燃
料電池;乙池中的兩個電極均為石墨電極,乙池中盛有100mL 3.00mol.L﹣1的CuSO4溶液.請回答下列問題: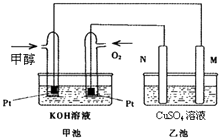
(1)M的電極反應式為
(2)當乙池中某一電極析出金屬銅6.4g時,甲池中理論上消耗氧氣為多少L.(標準狀況)
(3)若乙池中兩電極產生的氣體恰好相等時(假設標準狀況下),理論上需通入g甲醇.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素T,Q,R,W在元素周期表中的位置如圖所示,其中T所處的周期序數與主族族序數相等.它們的最高價氧化物的水化物依次為甲、乙、丙、丁.下列敘述不正確的是( ) 
A.R的氫化物可以既有極性鍵又有非極性鍵
B.常溫下丁的濃溶液可用T單質所制的容器來盛裝
C.丁的濃溶液與Q的單質加熱發生反應,可生成體積比為1:2的兩種氣體
D.甲、乙、丙、丁受熱均易分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CO2+Ca(OH)2![]() CaCO3↓+H2O,CaCO3+CO2+H2O
CaCO3↓+H2O,CaCO3+CO2+H2O![]() Ca(HCO3)2,且Ca(HCO3)2易溶于水。試根據如圖所示裝置回答下列問題:
Ca(HCO3)2,且Ca(HCO3)2易溶于水。試根據如圖所示裝置回答下列問題:
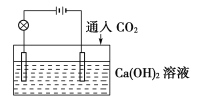
(1)通入CO2前,燈泡________(填“亮”或“不亮”)。
(2)開始通入CO2時,燈泡的亮度________。
(3)繼續通入過量的CO2,燈泡的亮度________。
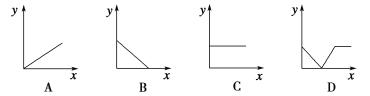
(4)下列四個圖中,_______(填字母)能比較準確地反映出溶液的導電能力和通入CO2氣體量的關系(x軸表示CO2通入的量,y軸表示導電能力)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】尿黑酸是由酪氨酸在人體內非正常代謝而產生的一種物質.其轉化過程如下: 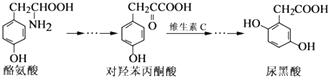
下列說法錯誤的是( )
A.酪氨酸既能與鹽酸反應,又能與氫氧化鈉反應
B.1 mol尿黑酸與足量濃溴水反應,最多消耗3 mol Br2
C.對羥基苯丙酮酸分子中在同一平面上的碳原子至少有7個
D.1 mol尿黑酸與足量NaHCO3反應,最多消耗3 mol NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作均要用玻璃棒,其中玻璃棒作用相同的是( )
①過濾 ②蒸發 ③向容量瓶轉移液體
A. ①和③ B. ①和② C. ②和③ D. ①②③
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com