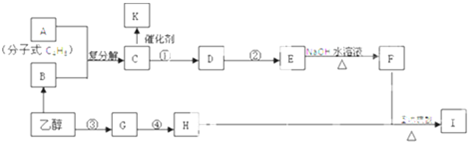
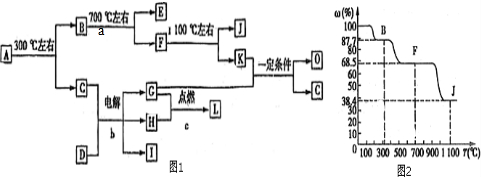
分析:化合物A是尿路結石的主要成分,可用X?nH
2O表示,在300℃下分解得到B與C,B繼續加熱分解得到的E被人體吸入,與血紅蛋白結合而使人中毒,則E為CO,K的大量排放是造成地球溫室效應的主要原因,則K為CO
2,故C為H
2O,D中的陽離子與C(水)分子有相同的電子數,D晶體中陰、陽離子個數比都是1:1,電解D的溶液得到三種物質G、H、I,應是電解NaCl溶液,則D為NaCl,G與H在點燃條件下反應生成L,則G、H分別為氫氣、氯氣中的一種,L為HCl,I為NaOH;K與G反應得到O與C(水),故G為H
2、H為Cl
2,由(4)中O是一種易揮發的液態燃料,有毒,誤飲5~10mL會導致雙目失明,則O為CH
3OH.A中的陽離子與D中的陰離子的電子層結構相同,則A中陽離子為Ca
2+,故X中含有Ca、C、O元素,結合X含有的三種元素的原子個數之比為1:2:4,故X為CaC
2O
4,圖上數據100到87.7為失去結晶水的過程,則
=1-87.7%,解得n=1,可以確定A為CaC
2O
4?H
2O,則B為CaC
2O
4,A的相對分子質量為146,F的相對分子質量為146×68.5%=100,故F為CaCO
3,J的相對分子質量為146×38.4%=56,故J為CaO,據此解答.
解答:
解:化合物A是尿路結石的主要成分,可用X?nH
2O表示,在300℃下分解得到B與C,B繼續加熱分解得到的E被人體吸入,與血紅蛋白結合而使人中毒,則E為CO,K的大量排放是造成地球溫室效應的主要原因,則K為CO
2,故C為H
2O,D中的陽離子與C(水)分子有相同的電子數,D晶體中陰、陽離子個數比都是1:1,電解D的溶液得到三種物質G、H、I,應是電解NaCl溶液,則D為NaCl,G與H在點燃條件下反應生成L,則G、H分別為氫氣、氯氣中的一種,L為HCl,I為NaOH;K與G反應得到O與C(水),故G為H
2、H為Cl
2,由(4)中O是一種易揮發的液態燃料,有毒,誤飲5~10mL會導致雙目失明,則O為CH
3OH.A中的陽離子與D中的陰離子的電子層結構相同,則A中陽離子為Ca
2+,故X中含有Ca、C、O元素,結合X含有的三種元素的原子個數之比為1:2:4,故X為CaC
2O
4,圖上數據100到87.7為失去結晶水的過程,則
=1-87.7%,解得n=1,可以確定A為CaC
2O
4?H
2O,則B為CaC
2O
4,A的相對分子質量為146,F的相對分子質量為146×68.5%=100,故F為CaCO
3,J的相對分子質量為146×38.4%=56,故J為CaO,
(1)D為NaCl,其中陰離子為Cl
-,Cl
-離子結構示意圖為

,反應a的化學方程式為:CaC
2O
4CaCO
3+CO↑,
故答案為:

;CaC
2O
4CaCO
3+CO↑;
(2)由題可知,B為CaC
2O
4,C為H
2O,圖2中數據100到87.7為失去結晶水的過程,則
=1-87.7%,解得n=1,所以A的分子式為CaC
2O
4?H
2O,
故答案為:CaC
2O
4?H
2O;由題可知,B為CaC
2O
4,C為H
2O,圖2中數據100到87.7為失去結晶水的過程,則
=1-87.7%,解得n=1,所以A的分子式為CaC
2O
4?H
2O;
(3)J溶于水后的懸濁液與H反應的離子方程式為:Cl
2+Ca(OH)
2=Cl
-+Ca
2++ClO
-+H
2O,
故答案為:Cl
2+Ca(OH)
2=Cl
-+Ca
2++ClO
-+H
2O;
(4)氫氣和二氧化碳反應生成的O是一種易揮發的液態燃料,是有毒的物質,誤飲5-10mL會導致雙目失明,則O為CH
3OH,故答案為:CH
4O;
(5)O(CH
3OH)與醋酸發生反應的化學方程式為:CH
3OH+CH
3COOH
CH
3COOCH
3+H
2O;與乙酸甲酯同類物質的同分異構體的結構簡式為HCOOC
2H
5,
故答案為:CH
3OH+CH
3COOH
CH
3COOCH
3+H
2O;HCOOC
2H
5.

 ,反應a的化學方程式為:CaC2O4
,反應a的化學方程式為:CaC2O4 ;CaC2O4
;CaC2O4

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案