
【題目】已知:![]()
![]() 。下列說法正確的( )
。下列說法正確的( )
A.在相同條件下,1mol![]() 與1mol
與1mol![]() 的能量總和大于2mol
的能量總和大于2mol![]() 的能量
的能量
B.1mol![]() 與1mol
與1mol ![]() 反應生成2 mol液態HF放出的熱量小于270kJ
反應生成2 mol液態HF放出的熱量小于270kJ
C.該反應的逆反應是放熱反應
D.該反應過程的能量變化可用下圖來表示

科目:高中化學 來源: 題型:
【題目】工業上利用鋅焙砂(主要含ZnO、ZnFe2O4,還含有少量FeO、CuO等雜質)制取金屬鋅的工藝流程如下:

(1)酸浸時要將鋅焙砂粉碎,其目的是提高酸浸效率,為達到這一目的,還可采用的措施是_____(任答一條)。寫出ZnFe2O4溶于酸的離子方程式____________________________
(2)凈化Ⅰ中H2O2 參與反應的離子方程式為_________________________
(3)凈化Ⅱ中Y 的主要成分是________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業生產的純堿常含有少量的氯化鈉雜質。如圖是測定產品中碳酸鈉質量分數的實驗裝置,下列說法不正確的是( )

A.裝置乙中發生的反應方程式為H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
B.裝置甲的作用是除去空氣中的二氧化碳氣體
C.反應結束后再需緩緩鼓入空氣數分鐘
D.若實驗操作無誤,該裝置測得的碳酸鈉的質量分數結果偏小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著氮氧化物對環境及人類活動影響的日趨嚴重,如何消除大氣污染物中的氮氧化物成為人們關注的主要問題之一。
Ⅰ.利用NH3的還原性可以消除氮氧化物的污染,其中除去NO的主要反應如下:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)寫出一種可以提高NO的轉化率的方法:__________
(2)一定溫度下,在恒容密閉容器中按照n(NH3)︰n(NO) =2︰3充入反應物,發生上述反應。下列不能判斷該反應達到平衡狀態的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不變 C.容器內壓強不變 D.容器內混合氣體的密度不變 E.1molN—H鍵斷裂的同時,生成1molO—H鍵
(3)已知該反應速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分別是正、逆反應速率常數),該反應的平衡常數K=k正/k逆,則x=_____,y=_______。
(4)某研究小組將2molNH3、3molNO和一定量的O2充入2L密閉容器中,在Ag2O催化劑表面發生上述反應,NO的轉化率隨溫度變化的情況如圖所示:

①在5min內,溫度從420K升高到580K,此時段內NO的平均反應速率v(NO)=_______;
②在有氧條件下,溫度580K之后NO生成N2的轉化率降低的原因可能是___________。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一種可行的方法。NO和NO2不同配比混合氣通入尿素溶液中,總氮還原率與配比關系如圖。

(5)用尿素[(NH2)2CO]水溶液吸收體積比為1∶1的NO和NO2混合氣,可將N元素轉變為對環境無害的氣體。寫出該反應的化學方程式____。
(6)隨著NO和NO2配比的提高,總氮還原率降低的主要原因是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列反應的方程式或離子方程式:
(1)工業制粗硅的反應方程式:___;
(2)銅與氯化鐵溶液的離子方程式:___;
(3)氧化鐵和氫碘酸溶液反應的離子方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗小組擬探究改進Fe(OH)2的制取方法。
方案1:
①實驗藥品:FeS固體、稀硫酸溶液、NaHCO3溶液;
②實驗裝置如圖1。
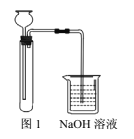
方案2:
①取一只試管,向其中加入一粒NaOH固體,再加入約2mL新制的FeSO4溶液;
②將試管置于酒精燈火焰上,對著有NaOH顆粒的部位小心加熱(不能使液體劇烈沸騰)。使沉淀自下至上慢慢增多,觀察下部沉淀顏色。
方案3:
①先在試管中滴入2~3 mL液體石蠟;
②用膠頭滴管小心往試管底部注入4~5 mL新制的FeSO4溶液;
③再往試管中投入1粒綠豆大小的金屬鈉,觀察反應現象。
回答下列問題:
(1)“方案1”中,后加入試管中的液體是______,NaOH溶液的作用是_______。
(2)“方案2”中,對著有NaOH顆粒的部位小心加熱的目的是________。
(3)“方案2”的沉淀中,上層沉淀的顏色是________,下層沉淀的顏色是________,發生此現象的原因是________。
(4)“方案3”中反應的化學反應方程式為________。
(5)“方案3”的實驗過程中間斷性的出現白色沉淀,其原因是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,向![]() 恒容密閉容器中充入
恒容密閉容器中充入![]() 和
和![]() ,發生反應:
,發生反應:![]() 。經過一段時間后達到平衡,反應過程中測定的部分數據見下表:
。經過一段時間后達到平衡,反應過程中測定的部分數據見下表:
| 0 | 2 | 4 | 6 | 8 |
| 0 |
|
|
|
|
下列說法正確的是
A.反應在前2s的平均速率![]()
B.保持其他條件不變,體積壓縮到![]() ,平衡常數將增大
,平衡常數將增大
C.相同溫度下,起始時向容器中充入![]() ,達到平衡時,
,達到平衡時,![]() 的轉化率大于
的轉化率大于![]()
D.保持溫度不變,向該容器中再充入![]() 、
、![]() ,反應達到新平衡時
,反應達到新平衡時![]() 增大
增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,向容積為2L的密閉容器中充入一定量的SO2和O2,發生反應2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段時間后達平衡,反應過程中測定的部分數據見下表:
2SO3(g) H=-196kJ·moL1,一段時間后達平衡,反應過程中測定的部分數據見下表:
反應時間/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列說法不正確的是
A. 反應在前5min的平均速率為v (SO2)=0.08mol·L1·min1
B. 保持溫度不變,向平衡后的容器中再充入1molSO2和0.5molO2時,v (正)> v (逆)
C. 該溫度,反應的平衡常數為11.25L·mol-1
D. 相同溫度下,起始時向容器中充入1.5mol SO3,達平衡時SO3的轉化率為40%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com