
【題目】H2S在金屬離子的鑒定分析、煤化工等領域都有重要應用。請回答:
I.工業上一種制備H2S的方法是在催化劑、高溫條件下,用天然氣與SO2反應,同時生成兩種能參與大氣循環的氧化物。
(1)該反應的化學方程式為________________________。
II.H2S可用于檢測和沉淀金屬陽離子。
(2)H2S的第一步電離方程式為____________。
(3)己知:25℃時,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,該溫度下,向濃度均為0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,當Sn2+開始沉淀時,溶液中c(Cd2+)=_________(溶液體積變化忽略不計)。
Ⅲ.H2S是煤化工原料氣脫硫過程的重要中間體。反應原理為
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:斷裂1 mol分子中的化學鍵所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容積不變的密閉容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),進行上述兩個反應。其他條件不變時,體系內CO的平衡體積分數與溫度(T)的關系如圖所示。
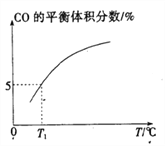
①隨著溫度升高,CO的平衡體積分數____________(填“增大”或“減小”),原因為_______________。
②T1℃時,測得平衡時體系中COS的物質的量為0.80 mol。則該溫度下,COS的平衡轉化率為_________;反應i的平衡常數為____________(保留兩位有效數字)。
【答案】 4SO2+3CH4 ![]() 4H2S+3CO2+2H2O H2S
4H2S+3CO2+2H2O H2S![]() H ++HS- 8.0×10-3mol·L-1 1076 增大 反應I為吸熱反應,升高溫度,平衡正向移動,CO的平衡體積分數增大;反應II為放熱反應,升高溫度,平衡逆向移動,CO的平衡體積分數也增大。 20% 0.044
H ++HS- 8.0×10-3mol·L-1 1076 增大 反應I為吸熱反應,升高溫度,平衡正向移動,CO的平衡體積分數增大;反應II為放熱反應,升高溫度,平衡逆向移動,CO的平衡體積分數也增大。 20% 0.044
【解析】I.(1) 天然氣與SO2反應,可制備H2S,同時生成兩種能參與大氣循環的氧化物應為H2O和CO2,則該反應的化學方程式為4SO2+3CH4 ![]() 4H2S+3CO2+2H2O;
4H2S+3CO2+2H2O;
II.(2) H2S是二元弱酸,在溶液中分步電離,第一步電離方程式為H2S![]() H ++HS- ;
H ++HS- ;
(3) 當Sn2+開始沉淀時,根據Ksp(SnS)=c(Sn2+)×c(S2-)=1.0×10-25,可知此時溶液中c(S2-)=1.0×10-25÷0.1=1.0×10-24mol·L-1,則溶液中c(Cd2+)=Ksp(CdS)÷c(S2-)=8.0×10-27÷1.0×10-24mol·L-1=8.0×10-3mol·L-1 ;
Ⅲ.(4)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1,則△H=(xkJ·mol-1+930kJ·mol-1)-(1606 kJ·mol-1+442 kJ·mol-1)=-42 kJ·mol-1,解得x=1076 kJ·mol-1;
CO2(g)+H2(g) △H =-42 kJ·mol-1,則△H=(xkJ·mol-1+930kJ·mol-1)-(1606 kJ·mol-1+442 kJ·mol-1)=-42 kJ·mol-1,解得x=1076 kJ·mol-1;
(5)①由圖示可知隨著溫度升高,CO的平衡體積分數增大,原因為反應I為吸熱反應,升高溫度,平衡正向移動,CO的平衡體積分數增大;反應II為放熱反應,升高溫度,平衡逆向移動,CO的平衡體積分數也增大。;
②平衡時COS的轉化率為![]() ×100%=20%;
×100%=20%;
COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始物質的量(mol) 1 1 0 0
變化物質的量(mol ) 0.2 0.2 0.2 0.2
平衡物質的量(mol) 0.8 0.8 0.2 0.2
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始物質的量(mol) 0.2 1 0 0.8
變化物質的量(mol ) x x x x
平衡物質的量(mol) 0.2-x 1-x x 0.8+x
此時CO的體積分數為5%,即0.2-x=3×5%,解得x=0.05,則平衡時COS的物質的量為0.8mol,H2的物質的量為0.85mol,CO的物質的量為0.15mol,H2S的物質的量為0.2mol,則T1℃時,反應i的平衡常數為![]() =
=![]() =0.044。
=0.044。


科目:高中化學 來源: 題型:
【題目】【百強校·2016屆山西大學附中12月月考】已知熱化學方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反應Ⅰ)
CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反應Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反應Ⅱ)
CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反應Ⅱ)
假設某溫度下,反應Ⅰ的速率(v1)大于反應Ⅱ的速率(v2),則下列反應過程能量變化示意圖正確的是 ( )

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數,下列說法正確的是( )
A. 0.5 molAl與足量鹽酸反應轉移電子數為1NA
B. 標準狀況下,11.2L SO3所含的分子數為0.5NA
C. 0.1molCH4所含的電子數為1NA
D. 46gNO2和N2O4的混合物含有的分子數為1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯消毒劑是國際上公認的含氯消毒劑中唯一的高效消毒滅菌劑,實驗室中KClO3和濃鹽酸在一定溫度下反應會生成二氧化氯,其變化可表述為:
2KClO3 +4HCl(濃)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)請分析該反應中電子轉移的情況:(單線橋法表示)________________。
(2)氧化劑與還原劑的物質的量之比是________________。
(3)若產生標況下22.4 L Cl2,則轉移的電子的物質的量為________________mol。
(4)實驗室備用的濃鹽酸質量分數為36.5%,密度為1.19 g·cm—3,為使用方便,請計算出該濃鹽酸中HCI的物質的量濃度________________mol·L—l。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴經催化加氫后,不能得到2-甲基丁烷,該烴是
A. 2-甲基-1-丁烯 B. 2-甲基-2-丁烯 C. 3-甲基-1-丁炔 D. 3,3-二甲基-1-丁炔
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于現行的元素周期表的說法正確的是( )
A.短周期是指第一、二周期
B.IA族的元素全部是金屬元素
C.元素周期表有8個副族
D.元素周期表有18個縱行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【2016年浙江卷】催化還原CO2是解決溫室效應及能源問題的重要手段之一。研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生兩個平行反應,分別生成CH3OH和CO。反應的熱化學方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某實驗室控制CO2和H2初始投料比為1:2.2,在相同壓強下,經過相同反應時間測得如下實驗數據:

【備注】Cat.1:Cu/ZnO納米棒;Cat.2:Cu/ZnO納米片;甲醇選擇性:轉化的CO2中生成甲醇的百分比
已知:①CO和H2的標準燃燒熱分別為-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
請回答(不考慮溫度對ΔH的影響):
(1)反應I的平衡常數表達式K=;反應II的ΔH2=kJ·mol-1。
(2)有利于提高CO2轉化為CH3OH平衡轉化率的措施有。
A.使用催化劑Cat.1
B.使用催化劑Cat.2
C.降低反應溫度
D.投料比不變,增加反應物的濃度
E.增大CO2和H2的初始投料比
(3)表中實驗數據表明,在相同溫度下不同的催化劑對CO2轉化成CH3OH的選擇性有顯著的影響,其原因是。
(4)在圖中分別畫出反應I在無催化劑、有Cat.1和有Cat.2三種情況下“反應過程~能量”示意圖。

(5)研究證實,CO2也可在酸性水溶液中通過電解生成甲醇,則生成甲醇的反應發生在極,該電極反應式是。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com