
【題目】ClO2是一種優良的消毒劑,熔點為-59.5℃,沸點為11.0℃,濃度過高時易發生分解引起爆炸,實驗室在50℃時制備ClO2。
實驗Ⅰ:制取并收集ClO2,裝置如圖所示:
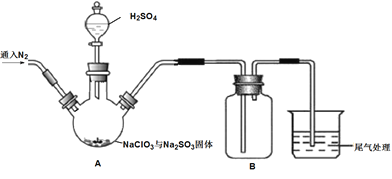
(1)寫出用上述裝置制取ClO2的化學反應方程式_____________。
(2)裝置A中持續通入N2的目的是___________。裝置B應添加__________(填“冰水浴”、“沸水浴”或“50℃的熱水浴”)裝置。
實驗Ⅱ:測定裝置A中ClO2的質量,設計裝置如圖:
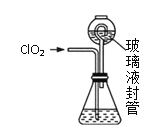
過程如下:
①在錐形瓶中加入足量的碘化鉀,用100mL水溶解后,再加3mL硫酸溶液;
②按照右圖組裝好儀器;在玻璃液封管中加入①中溶液,浸沒導管口;
③將生成的ClO2由導管通入錐形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入錐形瓶中,洗滌玻璃液封管2—3次,都倒入錐形瓶,再向錐形瓶中加入幾滴淀粉溶液;
④用c mol·L1 Na2S2O3標準液滴定錐形瓶中的液體,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I+S4O62-)。
(3)裝置中玻璃液封管的作用是_____________。
(4)滴定終點的現象是___________________。
(5)測得通入ClO2的質量m(ClO2)=_______g(用整理過的含c、V的代數式表示)。
【答案】![]() 降低ClO2的濃度,防止ClO2的濃度過高而發生分解,引起爆炸 冰水浴 防止ClO2逸出,使ClO2全部反應,準確測定ClO2的質量 溶液由藍色變為無色,并且在30s內顏色不發生變化 1.35×10-2cV
降低ClO2的濃度,防止ClO2的濃度過高而發生分解,引起爆炸 冰水浴 防止ClO2逸出,使ClO2全部反應,準確測定ClO2的質量 溶液由藍色變為無色,并且在30s內顏色不發生變化 1.35×10-2cV
【解析】
Ⅰ.(1)根據題給信息可知:NaClO3與亞硫酸鈉在酸性條件下反應生成ClO2和硫酸鈉等物質;
(2)二氧化氯(ClO2)沸點為11℃,NaClO3與亞硫酸鈉在酸性條件下生成二氧化氯等物質, ClO2濃度過高時易發生分解引起爆炸,ClO2的沸點低,用冰水可以使ClO2冷凝為液體;
Ⅱ. (3)用水再次吸收殘余的二氧化氯氣體,并使錐形瓶內外壓強相等,準確測量;
(4)溶液由藍色恰好變為無色,且半分鐘內不褪色,說明滴定至終點;
(5)根據氧化還原反應分析,有關系式2ClO2~5I2~10Na2S2O3計算n(ClO2),再根據m=nM計算m(ClO2)。
Ⅰ.(1)根據題給信息可知:NaClO3與亞硫酸鈉在酸性條件下反應生成ClO2和硫酸鈉等物質,則化學反應方程式為:![]() ,故答案為:
,故答案為:![]() ;
;
(2)二氧化氯(ClO2)沸點為11℃,NaClO3與亞硫酸鈉在酸性條件下生成二氧化氯等物質, ClO2濃度過高時易發生分解引起爆炸,通入氮氣,及時排出;ClO2的沸點低,用冰水可以使ClO2冷凝為液體,故答案為:降低ClO2的濃度,防止ClO2的濃度過高而發生分解,引起爆炸;冰水浴;
Ⅱ. (3)裝置中玻璃液封管的作用是,防止ClO2逸出,使ClO2全部反應,準確測定ClO2的質量,故答案為:防止ClO2逸出,使ClO2全部反應,準確測定ClO2的質量;
(4)當滴入(最后)一滴標準液時,溶液由藍色恰好變為無色,且半分鐘內不褪色,說明滴定至終點,故答案為:溶液由藍色變為無色,并且在30s內顏色不發生變化;
(5)VmLNa2S2O3溶液含有Na2S2O3物質的量n(Na2S2O3)=V10-3 L×cmol/L=cV10-3 mol.則:根據關系式: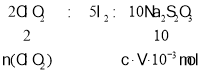 ,所以n(ClO2)=
,所以n(ClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×cV10-3 mol,所以m(ClO2)=n(ClO2) M=
×cV10-3 mol,所以m(ClO2)=n(ClO2) M=![]() ×cV10-3 mol×67.5g/mol=1.35cV×10-2g,故答案為:1.35cV×10-2。
×cV10-3 mol×67.5g/mol=1.35cV×10-2g,故答案為:1.35cV×10-2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列關于功能高分子材料的說法不正確的是( )
A.生物高分子材料、隱身材料、液晶高分子材料等屬于功能高分子材料
B.高分子分離膜可用于海水淡化、分離工業廢水、濃縮天然果汁等
C.用于制造![]() 芯片的良好半導體材料單晶硅屬于功能高分子材料
芯片的良好半導體材料單晶硅屬于功能高分子材料
D.在淀粉、纖維的高分子鏈上再接上含強親水性原子團的支鏈,可提高它們的吸水能力
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高分子化合物![]() 的合成路線如下:
的合成路線如下:
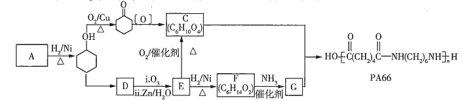
已知: 。
。
(1)![]() 的相對分子質量為94,屬于芳香化合物,其結構簡式是____________。
的相對分子質量為94,屬于芳香化合物,其結構簡式是____________。
(2)![]() 的反應條件是__________;
的反應條件是__________;![]() 的化學方程式是__________________。
的化學方程式是__________________。
(3)![]() 中所含官能團的名稱是_______________。
中所含官能團的名稱是_______________。
(4)![]() 有多種同分異構體,寫出符合下列條件的一種同分異構體的結構簡式:_______________。
有多種同分異構體,寫出符合下列條件的一種同分異構體的結構簡式:_______________。
i.屬于醇類 ii.所有碳原子之間均以單鍵相連
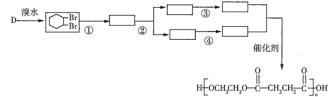
(5)只用有機物![]() 可合成聚丁二酸乙二酯,請結合題中信息補充完整下列合成路線__________(方框中用結構簡式表示有機物,用箭頭表示轉化關系,在箭頭上注明試劑和反應條件)。
可合成聚丁二酸乙二酯,請結合題中信息補充完整下列合成路線__________(方框中用結構簡式表示有機物,用箭頭表示轉化關系,在箭頭上注明試劑和反應條件)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某模擬“人工樹葉”電化學實驗裝置如圖所示,該裝置能將H2O和CO2轉化為O2和燃料(C3H8O)。下列說法正確的是
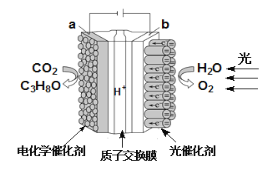
A.該裝置工作時,H+從a極區向b極區遷移
B.該裝置將化學能轉化為光能和電能
C.a電極的反應式為3CO2+18H+-18e-=C3H8O+5H2O
D.每生成3 mol O2,有88 g CO2被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據某有機物的結構:
(1)測定實驗式:某含碳、氫、氧三種元素的有機物,經燃燒分析實驗測定其碳的質量分數是64.86%,氫的質量分數是13.51%,則其實驗式是________。
(2)確定分子式:下圖是該有機物的質譜圖,則其相對分子質量為______,分子式為________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中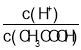 減小
減小
B.將CH3COONa溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C.向鹽酸中加入氨水至中性,溶液中![]() >1
>1
D.將0.1mol/L的NaOH的溫度提高至80℃,溶液的pH變小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)一定條件下,將2molNO與2molO2置于恒容密閉容器中發生如下反應:2NO(g)+O2(g)![]() 2NO2(g),下列各項能說明反應達到平衡狀態的是_____________。
2NO2(g),下列各項能說明反應達到平衡狀態的是_____________。
A.體系壓強保持不變
B.混合氣體顏色保持不變
C.NO和O2的物質的量之比保持不變
D.每消耗1 molO2同時生成2 molNO
(2)CO可用于合成甲醇,一定溫度下,向體積為2L的密閉容器中加入CO和H2,發生反應CO(g)+2H2(g)![]() CH3OH(g),達平衡后測得各組分濃度:
CH3OH(g),達平衡后測得各組分濃度:
物質 | CO | H2 | CH3OH |
濃度(mol/L) | 0.9 | 1.0 | 0.6 |
回答下列問題:
①混合氣體的平均相對分子質量=_________________。
②平衡常數K=__________________。
③若將容器體積壓縮為1L,不經計算,預測新平衡中c(H2)的取值范圍是__________。
④若保持體積不變,再充入0.6molCO和0.4molCH3OH,此時v正______v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稀土元素是寶貴的戰略資源,我國的蘊藏量居世界首位,但近年來對其進行了掠奪性開采。二氧化鈰(CeO2)是一種重要的稀土化合物。以氟碳鈰礦(主要含CeFCO3)為原料制備CeO2的一種工藝流程如圖:
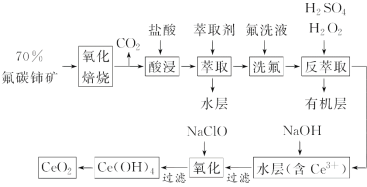
已知:①Ce4+能與F-結合成[CeFx](4-x)+,也能與SO42-結合成[CeSO4]2+;
②在硫酸體系中Ce4+能被萃取劑[(HA)2]萃取,而Ce3+不能。
回答下列問題:
(1)“氧化焙燒”中“氧化”的目的是__。
(2)“酸浸”中會產生大量黃綠色氣體,寫出CeO2與鹽酸反應的離子方程式:__。為避免產生上述污染,請提出一種解決方案:__。
(3)“萃取”時存在反應:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。如圖中D是分配比,表示Ce(Ⅳ)分別在有機層中與水層中存在形式的物質的量濃度之比(D=
Ce·(H2n-4A2n)+4H+。如圖中D是分配比,表示Ce(Ⅳ)分別在有機層中與水層中存在形式的物質的量濃度之比(D=![]() )。保持其他條件不變,D隨起始料液中c(SO42-)變化的原因:__(用平衡移動原理解釋)。
)。保持其他條件不變,D隨起始料液中c(SO42-)變化的原因:__(用平衡移動原理解釋)。
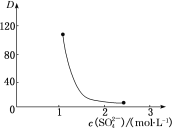
(4)若缺少“洗氟”,則所得產品的質量將__(填“偏大”“偏小”或“不變”)。
(5)“反萃取”中,H2O2作__(填“催化劑”“氧化劑”或“還原劑”)。
(6)“氧化”步驟的化學方程式為__。
(7)取上述流程中得到的CeO2產品0.4000g,加硫酸溶解后,用0.1000mol·L-1FeSO4標準溶液滴定至終點時(鈰被還原為Ce3+,其他雜質均不反應),消耗20.00mL標準溶液。該產品中CeO2的質量分數為__。滴定過程中可能造成實驗結果偏低的是__(填字母)。
A.使用久置的FeSO4標準溶液
B.滴定終點時仰視讀數
C.錐形瓶中溶液變色后立刻停止滴定,進行讀數
D.滴定管尖嘴內滴定前無氣泡,滴定終點發現氣泡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學--有機化學基礎】有機物G(![]() )是一種調香香精,可用作抗氧劑,工業上合成它的路線圖之一如下:
)是一種調香香精,可用作抗氧劑,工業上合成它的路線圖之一如下:

(1)A中官能團的名稱是_____,B→C的反應類型為_________。
(2)G分子中一定共平面的碳原子有______個。
(3)反應F→G中消耗的F與CH3MgBr的物質的量之比為______,B在濃硫酸存在下加熱可通過一步反應得到E物質,但合成不采用此方法,其原因是__________。
(4)C→D的化學方程式為_______________。
(5)E有多種同分異構體,其中滿足下列條件的同分異構體有_____種,寫出核磁共振氫譜有4個吸收蜂的物質的結構簡式:_______。
①含有一個六元環 ②1mol同分異構體與足量銀氨溶液發生銀鏡反應生成4 mol Ag
(6)已知A轉化為B的原理與F轉化為G的相似,請設計以A為起始原料(其他試劑任選)制備![]() 的合成路線______________。
的合成路線______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com