
【題目】下列各組微粒的空間構型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44-和SO42-
A. ②⑤B. ②③⑥C. ①②③④D. ③④⑤⑥
【答案】D
【解析】
①NH3中價層電子對個數=3+![]() =4且含有一個孤電子對,即N原子為sp3雜化,所以為三角錐形,H2O中心原子價層電子對個數=2+
=4且含有一個孤電子對,即N原子為sp3雜化,所以為三角錐形,H2O中心原子價層電子對個數=2+![]() =4且含有兩個孤電子對,即O原子為sp3雜化,所以為V形結構,二者空間構型不同,故①不符合題意;
=4且含有兩個孤電子對,即O原子為sp3雜化,所以為V形結構,二者空間構型不同,故①不符合題意;
②根據價層電子互斥理論可知,NH4+為正四面體形結構,H3O+中價層電子對個數是4且含有一對孤電子對,所以為三角錐形結構,二者空間構型不同,故②不符合題意;
③NH3為三角錐形結構、H3O+為三角錐形結構,所以二者空間構型相同,故③符合題意;
④O2、SO2中價層電子對個數都是3且都含有一對孤電子對,所以分子空間構型都是V形,故④符合題意;
⑤CO2和C2H2分子都是直線型分子,故⑤符合題意;
⑥SiO44-和SO42-中價層電子對個數都是4且不含孤電子對,所以空間構型都是正四面體結構,所以空間構型相同,故⑥符合題意;
故選D。


 新思維假期作業暑假吉林大學出版社系列答案
新思維假期作業暑假吉林大學出版社系列答案 藍天教育暑假優化學習系列答案
藍天教育暑假優化學習系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A. 標況下,224 L H2O含有的分子數為10NA
B. 1 mol任何氣體所含的原子數均為NA
C. 28 g CO所含的分子數為NA
D. 標況下,NA個分子的體積為22.4 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列關于充電電池、干電池的敘述合理的是___________。
①干電池可以實現化學能向電能的轉化和電能向化學能的轉化
②鋅錳干電池長時間連續使用時內裝糊狀物可能流出腐蝕電器
③充電電池可以無限制地反復放電、充電
④充電是使放電時的氧化還原反應逆向進行
(2)鉛蓄電池中,正極材料為PbO2,負極材料為Pb,放電時其負極反應式為_____________。
(3)原電池在NaOH溶液介質中,鋁為負極,其負極反應式為_______________。
(4)如圖為綠色電源“二甲醚(CH3OCH3)燃料電池”的工作原理示意圖。b電極是_____極,請寫出負極的電極反應方程式:___________________________。
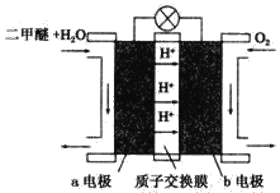
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以軟錳礦(主要成分為MnO2,還含有少量的Fe2O3、FeO、Al2O3和SiO2)為原料制備馬日夫鹽[Mn(H2PO4)2·2H2O(磷酸二氫錳)]的主要工藝流程如圖:
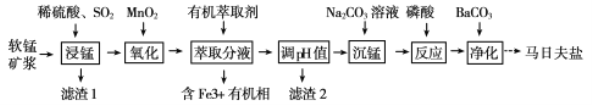
(1)用MnO2“氧化”時發生反應的離子方程式為__________________________________。
(2)如何檢驗“沉錳”己完成_____________________________________________________。
(3)鐵離子的萃取率與接觸時間和溶液的pH之間的關系如圖1、2所示,則應選擇的接觸時間為_______;pH>1.7,鐵離子的萃取率急劇下降的原因可能為____________________。
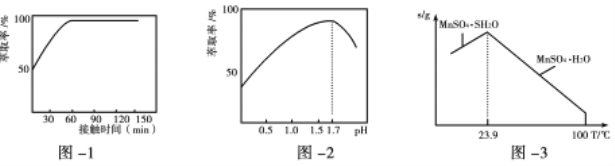
(4)結合圖3的溶解度曲線,請補充完整由浸錳得到的溶液制備MnSO4·H2O的實驗方案:邊攪拌邊向溶液中滴加適量的雙氧水,再向濾液中加入MnCO3粉末調節溶液的pH范圍為_________,過濾洗滌,將濾液與洗滌液合并,控制溫度在80℃~90℃之間蒸發濃縮、______________,(填操作名稱)得到MnSO4·H2O,用80℃~90℃的蒸餾水洗滌2~3次,放在真空干燥箱中低溫干燥。[已知該溶液中pH=7.8時Mn(OH)2開始沉淀:pH=5.0時Fe(OH)3、Al(OH)3沉淀完全,pH=8.8時Fe(OH)2沉淀完全]。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列中心原子的雜化軌道類型和分子幾何構型不正確的是
A. PCl3中P原子sp3雜化,為三角錐形
B. BCl3中B原子sp2雜化,為平面三角形
C. CS2中C原子sp雜化,為直線形
D. H2S分子中,S為sp雜化,為直線形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知17g H2R中含1mol H,則R的摩爾質量為__________。
(2)同溫同壓下,等體積的NH3氣和H2S氣的質量之比為__________。
(3)若由NH3和H2S組成的混合氣體的平均相對分子質量為20.4,則混合氣中NH3和H2S的分子數之比為__________。
(4)配制500mL 0.2mol/L Na2CO3溶液,需要用托盤天平稱量![]() 晶體的質量為__________ g。
晶體的質量為__________ g。
(5)將a L標準狀況下的氯化氫氣體溶于100mL水中(水的密度近似為1g/mL),得到密度為ρ g/mL的鹽酸,則該鹽酸的物質的量濃度是____________________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法中正確的有
①0.1mol丙烯酸中含有雙鍵的數目為0.1NA
②12g金剛石中,碳碳共價鍵數為4NA
③常溫下,21g C3H6和C4H8的混合物中含有的碳原子數為1.5NA
④2g ![]() 中含有的質子數、中子數、電子數均為NA
中含有的質子數、中子數、電子數均為NA
⑤常溫常壓下,S2和S6的混合物共6.4g,其中所含硫原子數一定為0.2NA
⑥10mL 18mol/L的濃硫酸與足量的鎂反應時轉移的電子數為0.18NA
A. ①⑥B. ④⑤⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室利用印刷電路的廢腐蝕液(含有大量CuCl2、FeCl2和FeCl3)回收Cu,主要流程如下:
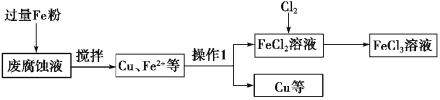
(1)操作1的名稱是__________,需要用到的玻璃儀器有________________________。
(2)加入過量鐵粉發生的離子反應有_______________。
(3)獲得的銅粉中含有雜質,除雜所需的試劑是_______________(填化學式)。
(4)實驗室利用如圖所示裝置制取一定量的FeCl3。
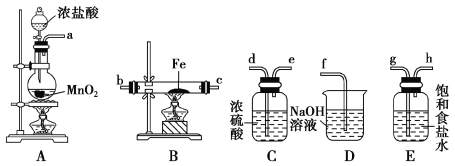
各裝置的正確連接順序為(填寫裝置代號)A→______→______→______→D。裝置C的作用是____________________________,寫出裝置D中反應的離子方程式:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為實驗室某濃鹽酸試劑瓶上的有關數據,根據標簽上的有關數據回答下列問題:
鹽酸
分子式:HCl
相對分子質量:36.5
密度:1.19g/cm3
質量分數:36.5%
(1)該濃鹽酸的物質的量濃度是___mol/L。
(2)取用任意體積的濃鹽酸時,下列物理量不隨所取體積的多少而變化的是___。
A.溶液中HCl的物質的量 B.溶液的濃度
C.溶液中Cl-的數目 D.溶液的密度
(3)某學生用上述濃鹽酸和蒸餾水配制100mL物質的量濃度為2.00mol/L的稀鹽酸。
①該學生需要量取___mL(保留一位小數)上述濃鹽酸進行配制。
②需要使用的實驗儀器有:燒杯、玻璃棒、量筒、__和___。
③配制過程中,下列實驗操作對所配制的稀鹽酸的物質的量濃度有何影響?(在橫線上填寫“偏大”、“偏小”或“無影響”)
a.用量筒量取濃鹽酸時俯視___;
b.向容量瓶中滴加蒸餾水定容時俯視__;
c.轉移前,容量瓶中含有少量蒸餾水__。
(4)取所配制的2mol/L的稀鹽酸50mL,加入足量的碳酸鈣固體,求可以制得標準狀況下的CO2氣體體積___?若忽略反應過程中的體積變化,求所得溶液中CaCl2的物質的量濃度?(寫出解題過程)。___
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com