
【題目】Fe和Fe2O3的混合物15g,加入150mL稀硫酸中,標準狀況下放出H21.68L,同時固體全部溶解.向溶液中滴加硫氰化鉀溶液后,未見顏色變化.若向溶液中加入3molL﹣1 NaOH溶液200mL,恰好使鐵元素全部沉淀.則該稀硫酸的物質的量濃度為( )
A.2.25molL﹣1
B.2molL﹣1
C.0.6molL﹣1
D.0.3molL﹣1
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在生產、生活中有著廣泛的應用。某興趣小組的同學發現將一定量的鐵與濃硫酸加熱時,觀察到鐵完全溶解,并產生大量氣體,同時得到淺綠色酸性溶液。為此,他們設計了如下裝置驗證所產生的氣體(夾持裝置省略)并進行有關實驗。

(1)①若裝置A中的試管不加熱,則沒有明顯現象,原因是____________。
②證明有SO2 生成的現象是_____;為了證明氣體中含有氫氣,裝置B和C中加入的試劑分別為X、CuSO4,請寫出裝置B處反應的化學方程式________________。
(2)取裝置A試管中的溶液6mL,加入適量氯水恰好反應,再加入過量的KI溶液后,分別取2mL此溶液于3支小試管中進行如下實驗:
①第一支試管中加入1mLCCl4,充分振蕩、靜置,CCl4層呈紫色;
②第二支試管中加入1滴K3[Fe(CN)6] 溶液,生成藍色沉淀;
③第三支試管中加入1滴KSCN溶液,溶液變紅。
實驗②檢驗的離子是________________(填離子符號);實驗①和③說明:在I-過量的情況下,溶液中仍含有____(填離子符號),由此可以證明該離子與I-發生的氧化還原反應為_______。
(3)向盛有H202溶液的試管中加入幾滴裝置A試管中的溶液,溶液變成棕黃色,發生反應的離子方程式為_________________;一段時間后,溶液中有氣泡出現并放熱,隨后有紅褐色沉淀生成。產生氣泡的原因是________________;生成沉淀的原因是_______________ (用平衡移動原理解釋)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關反應速率的說法正確的是:
A. 用鐵片和稀硫酸反應制氫氣時,改用98%的硫酸可以加快反應速率
B. 100 mL 2 molL﹣1的鹽酸跟鋅片反應,加入適量的氯化鈉溶液,反應速率不變
C. 反應C(s)+H2O(g) ![]() CO(g)+H2(g)在一可變容積的密閉容器中進行,增加C的量 , 其反應速率增大
CO(g)+H2(g)在一可變容積的密閉容器中進行,增加C的量 , 其反應速率增大
D. 汽車尾氣中的NO和CO可以緩慢反應生成N2和CO2,減小壓強反應速率變慢:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機物的敘述正確的是( )
A.乙醇不能發生取代反應
B.C4H10有三種同分異構體
C.氨基酸、淀粉均屬于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鑒別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期的三種元素X、Y、Z,原子序數依次變小,原子核外電子層數之和是5.X元素原子最外電子層上的電子數是Y和Z兩元素原子最外電子層上的電子數的總和;Y元素原子的最外電子層上的電子數是它的電子層數的2倍,X和Z可以形成XZ3的化合物.請回答:
(1)X元素的名稱是;Y元素的名稱是;Z元素的名稱是: .
(2)XZ3化合物的分子式是 , 電子式是 .
(3)分別寫出X、Y的含氧酸的分子式、 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組為探究元素周期表中元素性質的遞變規律,設計了如下實驗:
Ⅰ.(1)將鈉、鉀、鎂、鋁各1mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:___________________與鹽酸反應最劇烈。
(2)向Na2S溶液中通入氯氣出現黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為__________________________________________
(3)資料顯示:鈉、鎂、鋁都可以用于制備儲氫的金屬氫化物。
NaH是離子化合物,能與水反應生成H2;NaAlH4是一種良好的儲氫材料,與水反應也能產生氫氣,其化學反應方程式為____________________________
Ⅱ.為驗證氯、溴、碘三種元素的非金屬性強弱,用下圖所示裝置進行試驗(夾持儀器已略去,氣密性已檢驗)
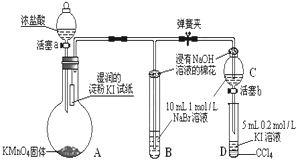
實驗過程:
①打開彈簧夾,打開活塞a,滴加濃鹽酸。
②當B和C中的溶液都變為黃色時,夾緊彈簧夾。
③當B中溶液由黃色變為棕紅色時,關閉活塞a。
④……
(4)A中發生反應生成氯氣,請寫出該反應的離子方程式:________________________
(5)B、C管口“浸有NaOH溶液的棉花”的作用是__________________________________________
(6)為驗證溴的氧化性強于碘,過程④的操作和現象是___________________________
(7)過程③實驗的目的是_________________________________________________
(8)請運用原子結構理論解釋氯、溴、碘非金屬性逐漸減弱的原因:_________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ已知34Se的原子結構示意圖如圖所示,回答下列問題:

(1)Se在元素周期表中的位置是__________。
(2)由Se在周期表中的位置分析判斷下列說法正確的是__________。
A.熱穩定性:PH3>H2S>H2Se B.還原性:H2Se>HBr>HCl
C.離子半徑:Se2->Cl->K+ D.酸性:HClO3>HBrO3>H2SeO3
Ⅱ在溫度t1和t2下,X2(g)和H2反應生成HX的平衡常數如下表:
化學方程式 | K(t1) | K(t2) |
F2+H2===2HF | 1.8×1036 | 1.9×1032 |
Cl2+H2===2HCl | 9.7×1012 | 4.2×1011 |
Br2+H2===2HBr | 5.6×107 | 9.3×106 |
I2+H2===2HI | 43 | 34 |
(1)已知,HX的生成反應是放熱反應,則溫度t2__________t1(填“<”或“>”)。
(2)用電子式表示HX的形成過程__________。
(3)共價鍵的極性隨共用電子對偏移程度的增大而增強,HX共價鍵的極性由強到弱的順序是__________。
(4)X2都能與H2反應生成HX,用原子結構解釋原因:__________。
(5)K的變化體現出X2化學性質的遞變性,用原子結構解釋原因:__________,原子半徑逐漸增大,得電子能力逐漸減弱。
(6)僅依據K的變化,可以推斷出:隨著鹵素原子核電荷數的增加,__________(選填字母)。
a.在相同條件下,平衡時X2的轉化率逐漸降低 b.HX的穩定性逐漸減弱
c.X2與H2反應的劇烈程度逐漸減弱 d.HX的還原性逐漸減弱
(7)不同鹵素原子之間可形成鹵素互化物,其性質與鹵素單質相近。寫出BrCl和SO2在水溶液中發生反應的化學方程式__________.
【答案】 第4周期第ⅥA族 BC > ![]() HF、HCl、HBr、HI 鹵素原子的最外層電子數都是7 同一主族元素從上至下原子核外電子層數依次增多 ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
HF、HCl、HBr、HI 鹵素原子的最外層電子數都是7 同一主族元素從上至下原子核外電子層數依次增多 ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
【解析】I.(1). 根據Se的原子結構示意圖可知,Se有四個電子層,最外層有6個電子,因電子層數等于周期數、最外層電子數等于主族序數,所以Se元素位于元素周期表的第4周期第VIA族,故答案為:第4周期第VIA族;
(2) A. 同一周期從左到右元素的非金屬性逐漸增強,同一主族從上到下元素的非金屬性逐漸減弱,則非金屬性S>P、S>Se,又因元素的非金屬性越強,其氣態氫化物熱穩定性越強,所以熱穩定性H2S>PH3、H2S>H2Se,故A錯誤;B. 非金屬性Cl>Br>Se,因非金屬性越強,其對應陰離子的還原性越弱,則還原性:H2Se>HBr>HCl,故B正確;C. 電子層數越多,離子半徑越大,則離子半徑Se2->Cl-,具有相同核外電子排布的離子,原子序數越大,離子半徑越小,則離子半徑Cl->K+,所以離子半徑:Se2->Cl->K+,故C正確;D. 最高價氧化物對應的水化物酸性越強,元素的非金屬性越強,但HClO3、HBrO3、H2SeO3均不是該元素的最高價氧化物對應的水化物,所以無法比較酸性強弱,故D錯誤;答案選BC;
II. (1). 因HX的生成反應是放熱反應,則升高溫度,平衡逆向移動,平衡常數減小,由表中數據可知,K(t1)>K(t2),說明t2>t1,故答案為:>;
(2). 因HX都是共價化合物,氫原子最外層電子與X原子最外層電子形成一對共用電子對,其形成過程可表示為:![]() ,故答案為:
,故答案為:![]() ;
;
(3). F、Cl、Br、I屬于ⅦA族元素,同主族元素自上而下隨著核電荷數的增大,原子核外電子層數逐漸增多,導致原子半徑逐漸增大,因此原子核對最外層電子的吸引力逐漸減弱,從而導致非金屬性逐漸減弱,即這四種元素得到電子的能力逐漸減弱,所以HF鍵的極性最強,HI的極性最弱,因此HX共價鍵的極性由強到弱的順序是HF、HCl、HBr、HI,故答案為:HF、HCl、HBr、HI;
(4). 鹵素原子的最外層電子數均為7個,在反應中均易得到1個電子而達到8電子的穩定結構,而H原子最外層有一個電子,在反應中也能得到1個電子而達到2電子的穩定結構,因此鹵素單質與氫氣化合時易通過一對共用電子對形成化合物HX,故答案為:鹵素原子的最外層電子數都是7;
(5). 平衡常數越大,說明反應越易進行,F. Cl、Br、I的得電子能力依次減小的主要原因是:同一主族元素從上至下原子核外電子層數依次增多,原子半徑逐漸增大,得電子能力逐漸減弱造成的,故答案為:同一主族元素從上至下原子核外電子層數依次增多;
(6). a. K值越大,說明反應的正向程度越大,即轉化率越高,故a正確;b. 反應的正向程度越小,說明生成物越不穩定,故b正確;而選項c、d都與K的大小無直接關系,故c、d錯誤;答案選ab;
(7). 不同鹵素原子之間可形成鹵素互化物,其性質與鹵素單質相近,根據氯氣與二氧化硫反應生成HCl和硫酸的原理可以推斷BrCl和SO2在水溶液中發生反應的化學方程式為:BrCl+SO2+2H2O=H2SO4+HCl+HBr,故答案為:BrCl+SO2+2H2O=H2SO4+HCl+HBr。
【題型】綜合題
【結束】
16
【題目】CH4超干重整CO2技術可得到富含CO的氣體,用于生產多種化工產品。該技術中的化學反應為:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下圖表示初始投料比n(CH4):n(CO2)為1:3或1:4,CH4的轉化率在不同溫度(T1、T2)下與壓強的關系。[注:投料比用a1、a2表示]
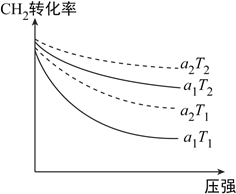
①a2=__________。
②判斷T1的T2的大小關系,并說明理由:__________。
(2)CH4超干重整CO2的催化轉化原理示意圖如下:

①過程Ⅰ,生成1mol H2時吸收123.5kJ熱量,其熱化學方程式是__________。
②過程Ⅱ,實現了含氫物種與含碳物種的分離。生成H2O(g)的化學方程式是__________。
③假設過程Ⅰ和過程Ⅱ中的各步均轉化完全,下列說法正確的是__________。(填序號)
a.過程Ⅰ和過程Ⅱ中發生了氧化還原反應
b.過程Ⅱ中使用的催化劑為Fe3O4和CaCO3
c.若過程Ⅰ投料![]() ,可導致過程Ⅱ中催化劑失效
,可導致過程Ⅱ中催化劑失效
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com