
設NA為阿伏加德羅常數的數值,下列說法正確的是B
A. 1 mol Na被完全氧化生成Na2O2,失去2NA個電子
B. 常溫常壓下,18 g H2O 中含有的原子總數為3NA
C. 5.6 g鐵粉與0.1molCl2反應轉移的電子數為0.3NA
D. 標準狀況下,14 g氮氣含有的核外電子數為5NA
科目:高中化學 來源:2017屆浙江省溫州市高三第二次選考模擬考試(2月)化學試卷(解析版) 題型:選擇題
下列說法不正確的是
A. 電解飽和食鹽水可制得黃綠色的氯氣
B. 鎂條著火時,不可用二氧化碳滅火
C. 工業煉鐵時,用焦炭直接還原氧化鐵得到鐵單質
D. 濃硫酸具有吸水性等特性,是因為濃硫酸中硫酸主要以分子形式存在
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省寶雞市高三教學質量檢測(一)理綜化學試卷(解析版) 題型:選擇題
某溶液中含有大量的K+、Cl-及X與Y兩種離子,現向該溶液加入W試劑,根據實驗現象得到的關于X、Y離子的推斷能成立的是
W試劑 | 實驗現象 | X、Y離子的推測 | |
A | KI—淀粉溶液 | 溶液變藍 | Fe3+、SO42- |
B | 用pH試紙檢測 | pH=7(常溫) | CH3COO-、Na+ |
C | 硝酸酸化的AgNO3溶液 | 白色沉淀 | CO32-、NH4+ |
D | 過量NaOH溶液 | 無明顯現象 | Al3+、Mg2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省汕頭市高一上學期期末考試化學試卷(解析版) 題型:實驗題
某化學小組欲探究FeCl3溶液、FeCl2溶液的化學性質
試劑清單:鐵粉、FeCl3溶液、FeCl2溶液、氯水、鋅片
請幫助他們完成以下實驗報告:
序號 | 實驗 目的 | 實驗內容 | 實驗現象 | 實驗結論 | 離子方程式 |
實驗1 | ① | 在FeCl2溶液中滴入適量 氯水 | 溶液由淺綠色 變為黃色 | ② | ③ |
實驗2 | ④ | 在FeCl2溶液中加入鋅片 |
| ⑤ | Zn +Fe2+= Zn2++Fe |
實驗3 | ⑥ | 在FeCl3溶液中加入足量 鐵粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
填空:
(1)①_____________③____________ ⑤____________⑧____________
綜合以上實驗,你能得到的結論是:Fe3+有氧化性;_________________。
(2)亞鐵鹽溶液易被氧化,短時間保存亞鐵鹽溶液時為防止亞鐵鹽被氧化可在溶液中加入少量______________(填試劑名稱)。
(3)檢驗某溶液是Fe2+溶液的方法是(任寫一種試劑及其對應的現象即可):________。
(4)某同學向FeCl2溶液中加入Na2O2,產生紅褐色沉淀,你認為該反應中產生紅褐色沉淀的原因可能是___。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省汕頭市高一上學期期末考試化學試卷(解析版) 題型:選擇題
既可以通過單質與單質化合,也可以通過溶液中的復分解反應來制得的化合物是
A. Na2O B. Na2O2 C. FeCl2 D. FeS
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省汕頭市高一上學期期末考試化學試卷(解析版) 題型:選擇題
下列各項操作中符合“先出現沉淀后沉淀完全溶解”現象的是( )
①向飽和碳酸鈉溶液中通入CO2 至過量
②向Fe(OH)3膠體中逐滴滴加稀H2SO4至過量
③向BaCl2溶液中通入CO2 至過量
④向澄清石灰水中逐漸通入CO2至過量
⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至過量
⑥向NaAlO2溶液中逐滴滴加鹽酸至過量
A. 全部 B. ②③④⑤⑥ C. ②③④⑥ D. ②④⑥
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省石家莊市高一上學期期末考試化學試卷(解析版) 題型:填空題
運用所學知識,回答下列問題。
I、向硫酸銅溶液中逐滴加入KI溶液至恰好反應完全,觀察到產生白色沉淀CuI,藍色溶液變為棕色。該反應的離子方程式為__________;取一定量上述反應后的上層棕色清液于一支試管中,加入一定量的苯,振蕩,此時觀察到的現象是________。
II、工業上用鋁土礦(主要成分為Al2O3,只含Fe2O3雜質)為原料冶煉鋁的工藝流程如下:
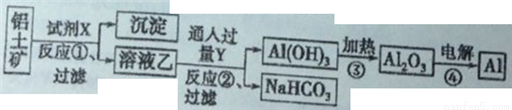
回答下列問題:
(1)上述反應是否都是氧化還原反應_________(填“是”或“否”);寫出反應①的化學方程式_____。
(2)反應①后過濾的沉淀為_______,簡述確定此物質中金屬元素及其價態的操作過程_______。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省石家莊市高一上學期期末考試化學試卷(解析版) 題型:選擇題
下列各組中的兩種物質作用時,反應條件或反應物的用量改變時,對生成物沒有影響的是
A. Na與O2 B. Na2O2與CO2 C. Ca(OH)2與NaHCO3 D. NaOH與CO2
查看答案和解析>>
科目:高中化學 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:簡答題
震驚全國的天津港“8.12”爆炸事故中,因爆炸沖擊導致氰化鈉泄漏而造成環境污染,可以通過噴灑雙氧水或硫代硫酸鈉溶液來處理。
資料:氰化鈉化學式NaCN(N元素-3價),白色結晶顆粒,劇毒,易溶于水
(1)NaCN用雙氧水處理后,產生一種酸式鹽和一種能使濕潤紅色石蕊試紙變藍的氣體,寫出該反應的化學方程式________________。
(2)某化學興趣小組實驗室制備硫代硫酸鈉(Na2S2O3),并檢測用硫代硫酸鈉溶液處理后的氰化鈉廢水能否達標排放。
【實驗一】實驗室通過下圖裝置制備Na2S2O3。
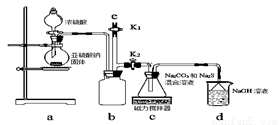
①a裝置中盛濃硫酸的儀器名稱是_______________;
b裝置的作用是________________。
②c裝置中的產物有Na2S2O3和CO2等,d裝置中的溶質有NaOH、Na2CO3,還可能有___________________。
③實驗結束后,在e處最好連接盛_________(選填“NaOH溶液”、“水”、“CCl4”中任一種)的注射器,再關閉K2打開K1,目的是__________________
【實驗二】測定用硫代硫酸鈉溶液處理后的廢水中氰化鈉的含量。
已知:
① 廢水中氰化鈉的最高排放標準為0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黃色,且CN-優先與Ag+反應。
實驗如下:
取25.00 mL處理后的氰化鈉廢水于錐形瓶中,并滴加幾滴KI溶液作指示劑,用1.000 ×10-4 mol/L的標準AgNO3溶液滴定,消耗AgNO3溶液的體積為2.50 mL。
④滴定終點的判斷方法是____________________
⑤處理后的廢水中氰化鈉的含量為__________mg/L,_______(選填“能”、“不能”)排放
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com