
【題目】SO2是評價空氣質量的污染物之一,主要來源于硫酸工廠的尾氣和含硫燃料的燃燒。
(1)硫酸廠尾氣一般采用吸收法處理。
①已知Ka(H2SO3)=1.54x10-2,Ka(HSO3-)=1.02x10-7,Kb(NH3·H2O)=1.77x10-5,將標準狀況下11.2L SO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶質是__________(填化學式),該溶液呈______________(填“酸”“堿”或“中”)性。
②下列關于①所得的溶液的關系正確的是_____________(填序號)。
A.2[c(NH4+)+c(NH3·H2O)]=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
D.c(NH4+)+c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+)
③常溫下,若用1LNaOH溶液吸收0.01mol SO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),則原NaOH溶液的pH值為___________。
(2)燃煤煙氣中可通過下列反應實現硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)
2CO2(g)+S(l)
①該反應的平衡常數表達式是____________。
②恒溫恒壓下,5分鐘時,反應到達平衡,氣體密度減小16g·L-1,則0-5分鐘內CO的反應速率是__________,若升高溫度氣體的密度增加,則該反應的△H__________0(填“>”或“<”)。
③下列措施,既能提高該反應的反應速率,又能提高SO2的吸收率的是__________(填序號)。
A. 加壓 B.增加SO2的濃度
B. 升高溫度 D.移走產物
(3)SO2還能被多種物質吸收。
①寫出SO2與Ba(NO3)2溶液反應的離子方程式:_______________。
②如果用含等物質的量溶質的下列個溶液分別吸收SO2,則理論吸收量由多到少的順序是__________(用序號排序)。
A. H2S B.Na2SO3
C.BaCl2 D.酸性KMnO4
【答案】(1)①(NH4)2SO3;堿性;②C;③12
(2)①![]() ;②0.2mol/Lmin;<;③A
;②0.2mol/Lmin;<;③A
(3)①2NO3-+3Ba2++3SO2+2H2O=2NO+3BaSO4↓+4H+;②DBAC
【解析】
試題分析:(1)①標準狀況下11.2L SO2的物質的量為0.5mol,含氨的物質的量為2L×0.5mol·L-1=1mol的氨水中,所得溶液中溶質是(NH4)2SO3;由于Ka(HSO3-)=1.02x10-7小于Kb(NH3·H2O)=1.77x10-5,所以該溶液呈堿性。故答案為:(NH4)2SO3;堿性;
②①所得的溶液的溶質為(NH4)2SO3。A.依據質量數:c(NH3)+c(NH4+)+c(NH3·H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],故A錯誤;B.依據電荷守恒:c(NH4+)+c(H+)= 2c(SO32-)+c(HSO3-)+c(OH-),故B錯誤;C.(NH4)2SO3溶液中離子濃度大小關系為:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故C正確;D.依據質量守恒關系式,且溶液呈堿性,則c(NH4+)+ c(OH-)>c(HSO3-)+2c(H2SO3)+ c(H+),故D錯誤。故答案為:C;
③常溫下,若用1LNaOH溶液吸收0.01molSO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),說明n(NaOH)=n(SO2)=0.01mol,則原NaOH溶液的c(H+)=Kw/c(OH-)=10-12mol/L,pH值為12。故答案為:12;
(2)①燃煤煙氣中可通過下列反應實現硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l),則該反應的平衡常數表達式是
2CO2(g)+S(l),則該反應的平衡常數表達式是![]() 。故答案為:
。故答案為:![]() ;
;
②已知恒溫恒容下,S不是氣體,且5分鐘時,反應到達平衡,氣體密度減小16g·L-1,則0-5分鐘內CO的濃度變化量為:△c(CO)=2×16g·L-1÷32g/mol=1.0mol/L,v(CO)=1.0mol/L÷5min=0.2mol/L min;依據方程式可知,S不是氣體,該反應的正反應是氣體密度減小的反應,若升高溫度氣體的密度增加,則該反應的△H<0。故答案為:0.2mol/L min;< ;
③A.加壓化學反應速率增大,平衡向正反應方向移動,SO2的吸收率提高,故A正確;B.增加SO2的濃度化學反應速率增大,平衡向正反應方向移動,但SO2的吸收率降低,故B錯誤;C.升高溫度化學反應速率增大,平衡向逆反應方向移動,SO2的吸收率
(3)①SO2還能被Ba(NO3)2溶液吸收,SO2與Ba(NO3)2溶液反應的離子方程式:2NO3-+3Ba2++3SO2+2H2O = 2NO+3BaSO4 ↓+4H+。
②依據化學方程式可知,如果均用含1mol溶質的下列個溶液分別吸收SO2,則理論吸收量A.H2S吸收0.5mol;B.Na2SO3吸收1mol;C.BaCl2與SO2不反應,不能吸收SO2;D.酸性KMnO4吸收2.5mol。即由多到少的順序是DBAC。故答案為:DBAC。


科目:高中化學 來源: 題型:
【題目】有機物A 的結構簡式為![]() ,它可通過不同化學反應分別制得B、C、D和E四種物質。
,它可通過不同化學反應分別制得B、C、D和E四種物質。

請回答下列問題:
(1)在A~E五種物質中,互為同分異構體的是______(填字母代號)。
(2)寫出由A生成B的化學方程式:________________。
(3)已知HCHO分子中所有原子在同一平面內,則上述分子中所有的原子有可能都在同一平面內的是______(填字母代號)。
(4)C能形成高聚物,該高聚物的結構簡式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】5.8g某有機物A完全燃燒只生成體積比為1:1(同壓同溫)的CO2和H2O蒸氣,若把它們通過堿石灰,堿石灰增加18.6g;等質量的有機物A與0.1 mol乙酸完全發生酯化反應。已知該有機物A蒸氣的密度是相同條件下空氣密度的2倍,其核磁共振氫譜中有4個信號峰。回答下列問題:
(1)有機物A的相對分子質量________________________;
(2)有機物A的分子式是________________________;
(3)有機物A的結構簡式是________________________;
(4)寫出有機物A與乙酸反應的化學方程式________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸鐵鋰電池裝置如圖所示,其中正極材料橄欖石型LiFePO4通過粘合劑附著在鋁箔表面,負極石墨材料附著在銅箔表面,電解質為溶解在有機溶劑中的鋰鹽。電池工作時的總反應為:LiFePO4+6C ![]() Li1-xFePO4+LixC6,則下列說法正確的是
Li1-xFePO4+LixC6,則下列說法正確的是

A. 圖中聚合物隔膜是陰離子交換膜;
B. 充電時,Li+ 遷移方向是“由右向左”
C. 放電時,正極的電極反應式為LiFePO4—xe- = Li1-xFePO4 + xLi+
D. 用該電池電解精煉銅,當轉移電子1.25mol時能得到精銅32g,則電子利用率為80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為提高合成洗滌劑的質量,一般要加入含磷的鹽。大量使用含磷洗衣粉會對環境造成嚴重的危害,我國目前已限制含磷洗衣粉的生產和使用。含磷洗衣粉對環境造成的危害主要有( )
A. 造成大氣中浮塵增多B. 造成農作物欠收
C. 引起酸雨D. 造成水體富營養化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,在10mL濃度均為0.1mol/L的NaOH和CH3COONa混合溶液中滴加0.1mol/L的鹽酸,所得滴定曲線如圖所示。下列說法正確的是
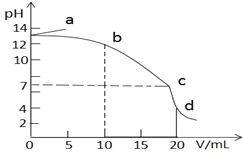
A. a點溶液加水稀釋,![]() 逐漸增大
逐漸增大
B. b→c段發生反應的離子方程式是:CH3COO- + H+ = CH3COOH
C. c點時水的電離程度最大
D. d點溶液中c(Na+)=c(Cl-)>c(CH3COOH)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E是短周期中原子序數依次增大的5種主族元素,其中A是組成有機物的必要元素,元素B的原子最外層電子數是其電子層數的3倍,元素D與A為同族元素,元素C與E形成的化合物CE是廚房常用調味品。下列說法正確的是
A. 原子半徑:C>D>A>B
B. C和E的單質可通過電解飽和的CE水溶液獲得
C. C與B形成的兩種化合物中化學鍵類型完全相同
D. A、D、E的最高價氧化物對應水化物的酸性逐漸增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關同分異構體數目的敘述中正確的是( )
A. 丙烷的2氯代物有3種同分異構體
B. C8H10中只有3種屬于芳香烴的同分異構體
C. 甲苯苯環上的一個氫原子被含3個碳原子的烷基取代,所得產物有6種
D. CH3CH2CH2CH3光照下與氯氣反應,只生成1種一氯代烴
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com