
分析 鐵粉、鎂粉與硫酸反應方程式為:Fe+H2SO4=H2↑+FeSO4、Mg+H2SO4=H2↑+MgSO4,根據n=$\frac{m}{M}$計算出ag鐵粉、bg鎂粉的物質的量,
(1)若$\frac{a}{56}$>m,$\frac{b}{24}$>m時,說明兩個燒杯中進入的鐵粉和鎂粉都是過量的,兩個燒杯中生成氣體的質量相等,只要滿足進入的鐵粉和鎂粉質量相等即可;
(2)若$\frac{a}{56}$<m,$\frac{b}{24}$<m時,說明加入的金屬不足,硫酸過量,金屬完全反應,利用差量法計算出兩邊燒杯中加入金屬的質量;
(3)若$\frac{a}{56}$<m,$\frac{b}{24}$>m時,說明鐵不足,鎂粉過量,利用差量法計算出加入鐵粉的燒杯中溶液增加的質量;加入鎂粉的燒杯中生成氫氣為mmol,質量為2mg,溶液增加的質量為:bg-2mg,若要天平平衡,兩個燒杯中增加的質量必須相等,據此找出a、b的關系.
解答 解:ag鐵粉的物質的量為:$\frac{ag}{56g/mol}$=$\frac{a}{56}$mol,bg鎂粉的物質的量為:$\frac{bg}{24g/mol}$=$\frac{b}{24}$mol,
鐵粉、鎂粉與稀硫酸反應的方程式為:Fe+H2SO4=H2↑+FeSO4、Mg+H2SO4=H2↑+MgSO4,
(1)若$\frac{a}{56}$>m,$\frac{b}{24}$>m時,說明兩個燒杯中進入的鐵粉和鎂粉都是過量的,生成氣體的質量相等,若要使天平仍然平衡,只要滿足進入的鐵粉和鎂粉質量相等即可,即:a=b,
故答案為:a=b;
(2)若$\frac{a}{56}$<m,$\frac{b}{24}$<m時,說明加入的金屬不足,硫酸過量,金屬完全反應,則:
Fe+H2SO4=H2↑+FeSO4 △m
56 2 54
ag $\frac{54a}{56}$g
Mg+H2SO4=H2↑+MgSO4,△m
24 2 22
bg $\frac{22b}{24}$g,
若要使天平仍然平衡,必須滿足:$\frac{54a}{56}$g=$\frac{22b}{24}$g,整理可得:$\frac{27}{28}$a=$\frac{11}{12}$b,
故答案為:$\frac{27}{28}$a=$\frac{11}{12}$b;
(3)若$\frac{a}{56}$<m,$\frac{b}{24}$>m時,說明鐵不足,鎂粉過量,
加入鎂粉的燒杯中生成氫氣的物質的量為m,生成氫氣的質量為2mg,則溶液質量增加為:bg-2mg=(b-2m)g,
加入鐵粉的燒杯中,鐵粉不足,硫酸過量,則燒杯增加量為:$\frac{54a}{56}$g,
若要使天平仍然平衡,必須滿足:$\frac{54a}{56}$g=(b-2m)g,即:$\frac{27}{28}$a=b-2m,
故答案為:$\frac{27}{28}$a=b-2m.
點評 本題考查了有關范圍討論的計算,題目難度中等,明確各范圍金屬與酸的過量情況為解答關鍵,注意掌握差量法在化學計算中的應用方法,試題側重考查學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:填空題
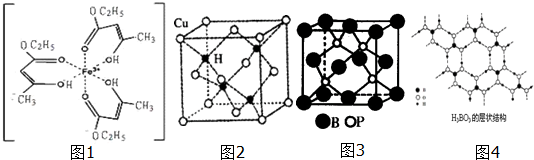
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硅的原子結構示意圖: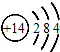 | |
| B. | 原子核內有8個中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 二氧化碳分子的電子式: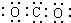 | |
| D. | 甲烷分子的比例模型: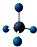 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
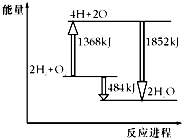 如圖為反應2H2(g)+O2(g)═2H2O(g)的能量變化示意圖,下列說法不正確的是( )
如圖為反應2H2(g)+O2(g)═2H2O(g)的能量變化示意圖,下列說法不正確的是( )| A. | 拆開2molH2(g)和1molO2(g)中的化學鍵成為H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反應生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反應生成2molH2O(g),共放出484kJ能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 根據下列裝置圖,回答問題.
根據下列裝置圖,回答問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸與堿恰好完全反應生成正鹽的溶液 | |
| B. | pH=7的溶液 | |
| C. | 使石蕊試液呈紫色的溶液 | |
| D. | c(H+)=c(OH-)=10-6mol•L-1的溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質量數為198 | B. | 中子數為140 | C. | 質子數為82 | D. | 核外電子數為58 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com