
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | c(A-)<c(B-) |
分析 HA的酸性比HB的酸性強,HA的電離程度大于HB,則其酸根離子水解程度A-<B-,相同溫度下,物質的量濃度和體積均相同的NaA和NaB兩種溶液中兩種鹽的物質的量相等,溶液中存在電荷守恒和物料守恒,根據電荷守恒判斷.
解答 解:HA的酸性比HB的酸性強,HA的電離程度大于HB,則其酸根離子水解程度A-<B-,相同溫度下,物質的量濃度和體積均相同的NaA和NaB兩種溶液中兩種鹽的物質的量相等,根據電荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-)、c(Na+)+c(H+)=c(OH-)+c(B-),兩種溶液中離子濃度分別是其溶液中所有陽離子濃度的2倍,
因為酸根離子水解程度A-<B-,所以NaA溶液中氫離子濃度大于NaB,兩種溶液中鈉離子濃度相等,所以NaA溶液中離子個數大于NaB離子個數,即n1>n2,
故選B.
點評 本題以離子個數比較為載體考查了鹽類水解,明確電離平衡常數與酸根離子水解程度的關系是解本題關鍵,然后再采用電荷守恒、離子代換等方法來分析解答,難度中等.


科目:高中化學 來源: 題型:解答題
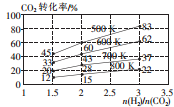 二氧化碳是造成溫室效應的主要氣體,二氧化碳的回收再利用是減緩溫室效應的有效途徑之一.
二氧化碳是造成溫室效應的主要氣體,二氧化碳的回收再利用是減緩溫室效應的有效途徑之一.| 溫度/K CO2轉化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 沉淀a的主要成分是BaS04和BaC03 | |
| B. | 濾液b中Na+的物質的量為0.08 mol | |
| C. | 氣體d在標準狀況下的體積為224 mL | |
| D. | 原混合物中Na2S04與Na2C03的物質的量之比為1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由H原子形成1 mol H-H鍵要吸收熱量 | |
| B. | 所有燃燒反應都是放熱反應 | |
| C. | 在稀溶液中,1 mol酸與1 mol堿發生中和反應生成水時所釋放的熱量稱為中和熱 | |
| D. | 在一定條件下,1mol H2 與足量的Cl2、Br2、I2 分別反應,放出熱量關系是I2>Br2>Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
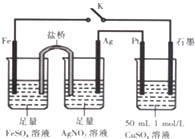
| A. | 鹽橋中的電解質可以用KC1 | |
| B. | 導線中流過0.2mol電子時,加入4.9gCu(OH)2,CuSO4溶液可恢復原組成 | |
| C. | 閉合K,石墨電極上只生成銅 | |
| D. | 閉合K,外電路電流方向為Fe電極→石墨電極 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10mL0.5mol/LCH3COONa溶液與6mL1mol/L鹽酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液與5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液與5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水與10mL0.1mol/L鹽酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com