
化工生產的副產氫也是氫氣的來源。電解法制取有廣泛用途的Na2FeO4,同時獲得氫氣:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如圖1所示。裝置通電后,鐵電極附近生成紫紅色的FeO42-,鎳電極有氣泡產生。若氫氧化鈉溶液濃度過高,鐵電極區會產生紅褐色物質。已知:Na2FeO4只有在強堿性條件下穩定,易被H2還原。
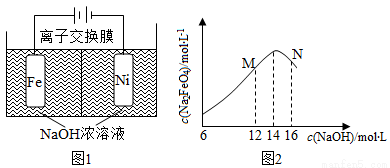
①電解一段時間后,c(OH-)降低的區域在__________(城 “陰極室”或“陽極室”)。
②電解過程中,須將陰極產生的氣體及時排出,其原因是________。
③c(Na2FeO4)隨初始c(NaOH)的變化如圖2,任選M、N兩點中的一點,分析c(Na2FeO4)低于最高值的原因:_____________。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年云南省高二上期中化學試卷(解析版) 題型:選擇題
下列有關化學反應速率的說法正確的是
A.用鐵片和稀硫酸反應制取氫氣時,改用98%的濃硫酸可以加快產生氫氣的速率
B.100ml 2mol/L的鹽酸跟鋅片反應時,加入適量的氯化鈉溶液,反應速率減慢
C.SO2的催化氧化是一個放熱反應,所以升高溫度,反應速率減慢
D.汽車尾氣中的NO和CO反應轉化為無害的N2和CO2,減小壓強,反應速率減慢
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省高二上11月考試化學卷(解析版) 題型:實驗題
測定平衡常數對定量認識化學反應具有重要意義。已知:I2能與 I-反應生成 I3-,并在溶液中建立如下平衡: I2+I- I3-。通過測平衡體系中 c(I2)、 c(I-)和 c(I3-),就可求得該反應的平衡常數。
I3-。通過測平衡體系中 c(I2)、 c(I-)和 c(I3-),就可求得該反應的平衡常數。
Ⅰ.某同學為測定上述平衡體系中 c(I2),采用如下方法:取 V1 mL 平衡混合溶液,用cmol·L-1的Na2S2O3溶液進行滴定(反應為 I2+2Na2S2O3=2NaI+Na2S4O6),消耗 V2 mL 的Na2S2O3溶液。根據V1、V2和c可求得c(I2)。
(1)上述滴定時,可采用________做指示劑,滴定終點的現象是_____________________。
(2)下列對該同學設計方案的分析,正確的是________(填字母)。
A.方案可行。能準確測定溶液中的 c(I2)
B.不可行。因為 I-能與 Na2S2O3發生反應
C.不可行。只能測得溶液中 c(I2)與 c(I3-)之和
Ⅱ.化學興趣小組對上述方案進行改進,擬采用下述方法來測定該反應的平衡常數(室溫條件下進行,溶液體積變化忽略不計):

已知: ①I-和 I3-不溶于 CCl4; ②一定溫度下, 碘單質在四氯化碳和水混合液體中,碘單質的濃度比值即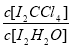 是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題:
是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題:
(3)操作Ⅰ使用的玻璃儀器中,除燒杯、玻璃棒外,還需要的儀器是________(填名稱)。試指出該操作中應注意的事項為________。 (任寫一條)
(4)上述測定過程均正常操作,下層液體中碘單質的物質的量濃度是________;若終點讀數時俯視滴定管, 則會造成所測濃度________ (填“等于”、 “大于”或“小于”)該值。
(5)實驗測得上層溶液中 c(I3-)=0.0049 mol·L-1,結合上述有關數據,計算室溫條件下反應 I2+I- I3-的平衡常數 K=________(用具體數據列出計算式即可)。
I3-的平衡常數 K=________(用具體數據列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省高二上11月考試化學卷(解析版) 題型:選擇題
在體積均為1.0 L的兩恒容密閉容器中加入足量的相同的碳粉,再分別加入0.1 mol CO2和0.2 mol CO2,在不同溫度下反應 CO2(g)+C(s)  2CO(g)達到平衡,平衡時CO2的物質的量濃度c(CO2)隨溫度的變化如下圖所示(圖中Ⅰ、Ⅱ、Ⅲ點均處于曲線上)。下列說法正確的是( )
2CO(g)達到平衡,平衡時CO2的物質的量濃度c(CO2)隨溫度的變化如下圖所示(圖中Ⅰ、Ⅱ、Ⅲ點均處于曲線上)。下列說法正確的是( )
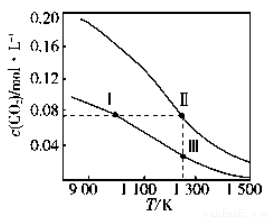
A.反應 CO2(g)+C(s)  2CO(g)的 ΔS>0、 ΔH<0
2CO(g)的 ΔS>0、 ΔH<0
B.體系的總壓強p總:p總(狀態Ⅱ) <2p總(狀態Ⅰ)
C.體系中 c(CO):c(CO,狀態Ⅱ)<2c(CO,狀態Ⅲ)
D.逆反應速率v逆: v逆(狀態Ⅰ)>v逆(狀態Ⅲ)
查看答案和解析>>
科目:高中化學 來源:2017屆重慶八中高三上學期定時訓練14化學試卷(解析版) 題型:選擇題
某電動汽車配載一種可充放電的鋰離子電池。放電時電池的總反應為:Li1-xCoO2+ LixC6=LiCoO2+C6(x<1)。下列關于該電池的說法不正確的是( )
A.放電時,Li+在電解質中由負極向正極遷移
B.放電時,負極的電極反應式為LixC6-xe-=xLi++C6
C.充電時,若轉移lmole-,石墨C6電極將增重7xg
D.充電時,陽極的電極反應式為LiCoO2-xe-= Li1-xCoO2+Li+
查看答案和解析>>
科目:高中化學 來源:2017屆云南省高三上第四次月考化學卷(解析版) 題型:選擇題
下列操作中,發生“先產生白色沉淀,然后沉淀又完全溶解”現象的是
A.向硫酸鋁溶液中逐滴滴入過量氫氧化鋇溶液
B.向硅酸膠體中逐滴滴入過量稀硫酸溶液
C.向氫氧化鐵膠體中逐滴滴入過量稀硫酸溶液
D.向氫氧化鋇溶液中緩緩通入過量二氧化碳
查看答案和解析>>
科目:高中化學 來源:2017屆山東省東營市高三上期中化學卷(解析版) 題型:選擇題
將一定量的氯氣通入30mL濃度為10.00mol/L的氫氧化鈉濃溶液中,加熱少許時間后溶液中形成NaCl、NaClO、NaClO3共存體系。下列判斷正確的是( )
A.與NaOH反應的氯氣一定為0.3 mol
B.n(Na+):n(Cl-)可能為7:3
C.若反應中轉移的電子為n mol,則0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能為11:2:1
查看答案和解析>>
科目:高中化學 來源:2017屆寧夏高三上學期統練三化學試卷(解析版) 題型:選擇題
下列有關化學反應速率與限度的說法,正確的是
A.任何可逆反應都有一定的限度,且限度是可以改變的
B.對任何化學反應來說,反應速率越大,則現象越明顯
C.決定化學反應速率的主要因素是溫度、濃度、壓強
D.鐵與稀硫酸反應制氫氣時,改用98.3%的濃疏酸,對增大化學反應速率明顯有效
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com