
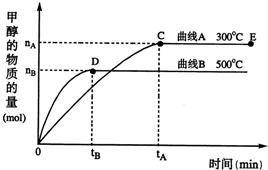
一定條件下,在體積為3 L的密閉容器中反應CO(g)+ 2H2(g)CH3OH(g)達到化學平衡狀態。
(1)該反應的平衡常數表達式K= ;根據下圖,升高溫度,K值將 增大壓強K值將 (填“增大”、“減小”或“不變”)。
(2)500℃時,從反應開始到達到化學平衡,以H2的濃度變化表示的化學反應速率是 (用nA 、nB、 tA 、tB表示)。
(3)判斷該可逆反應達到化學平衡狀態的標志是 (填字母)。
a. v生成(CH3OH)= v消耗(CO) b.混合氣體的密度不再改變
c.混合氣體的平均相對分子質量不再改變 d. CO、H2、CH3OH的濃度均不再變化
(4)300℃時,將容器的容積壓縮到原來的1/2,在其他條件不變的情況下,對平衡體系產生的影響是 (填字母)。
a. c(H2)減少 b正反應速率加快,逆反應速率減慢
c. CH3OH 的物質的量增加 d.重新平衡時c(H2)/ c(CH3OH)減小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根據題意完成下列各題:
一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根據題意完成下列各題:| 2n(B) |
| 3t(B) |
| 2n(B) |
| 3t(B) |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化學 來源: 題型:
 一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有關說法正確的是( )
一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有關說法正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍重視.目前工業上有一種方法是用CO2來生產燃料甲醇.一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):
隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍重視.目前工業上有一種方法是用CO2來生產燃料甲醇.一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO): CH3OH(g)
CH3OH(g)| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2| 點燃 |
| 點燃 |

查看答案和解析>>
科目:高中化學 來源: 題型:
 一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO).根據題意完成下列各題:
一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO).根據題意完成下列各題:| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com