
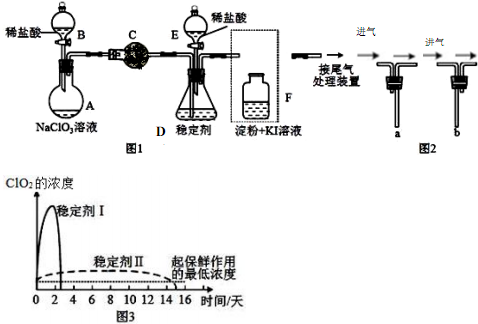
分析 (1)根據儀器特征,可知儀器C是球形干燥管;F裝置應是Cl2和KI反應,還需要連接尾氣處理裝置,所以應長管進氣,短管出氣;
(2)根據電子轉移守恒和原子守恒書寫氯酸鈉和稀鹽酸混和產生Cl2和ClO2的反應化學方程式,為使ClO2在D中被穩定劑充分吸收,產生ClO2的速率要慢;
(3)F裝置中發生Cl2+2KI=2KCl+I2時,碘遇淀粉變藍,而F中溶液的顏色不變,說明Cl2被吸收;
(4)在酸性條件下NaClO2可發生反應生成NaCl并釋放出ClO2,根據元素守恒可知應還有水生成,該反應的離子方程式為4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2釋放實驗中,打開E的活塞,D中發生反應,則裝置F的作用是驗證是否有ClO2 生成;
(5)由圖可知,穩定劑Ⅱ可以緩慢釋放ClO2,能較長時間維持保鮮所需的濃度.
解答 解:(1)根據儀器特征,可知儀器C是球形干燥管;F裝置應是Cl2和KI反應,還需要連接尾氣處理裝置,所以應長管進氣,短管出氣,故選b,
故答案為:球形干燥管;b;
(2)氯酸鈉和稀鹽酸混和產生Cl2和ClO2,NaClO3中氯為+5價被還原成ClO2中+4價,鹽酸中氯為-1價,被氧化成0價氯,轉移電子數為2,所以NaClO3、ClO2前系數為2,Cl2前系數為1,反應化學方程式:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,:為使ClO2在D中被穩定劑充分吸收,產生ClO2的速率要慢,故滴加稀鹽酸的速度要慢,即調節分液漏斗B的旋塞,減緩(慢)稀鹽酸滴加速度,
故答案為:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;調節分液漏斗B的旋塞,減緩(慢)稀鹽酸滴加速度;
(3)F裝置中發生Cl2+2KI=2KCl+I2時,碘遇淀粉變藍,而F中溶液的顏色不變,則裝置C的作用是吸收Cl2,
故答案為:吸收Cl2;
(4)在酸性條件下NaClO2可發生反應生成NaCl并釋放出ClO2,根據元素守恒可知應還有水生成,該反應的離子方程式為:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2釋放實驗中,打開E的活塞,D中發生反應,則裝置F的作用是驗證是否有ClO2 生成,
故答案為:4H++5ClO2-=Cl-+4ClO2↑+2H2O;檢驗是否有ClO2生成;
(5)由圖可知,穩定劑Ⅱ可以緩慢釋放ClO2,能較長時間維持保鮮所需的濃度,所以穩定劑Ⅱ好,
故答案為:穩定劑Ⅱ可以緩慢釋放ClO2,能較長時間維持保鮮所需的濃度.
點評 本題以ClO2的制備、吸收、釋放為載體考查實驗制備方案設計,為高頻考點,把握實驗基本操作、裝置的作用及物質的性質等為解答的關鍵,注意根據問題進行制備流程分析,題目難度中等.


科目:高中化學 來源: 題型:解答題
| 物質名稱 | 葡萄糖酸鈣 | 葡萄糖酸 | 溴化鈣 | 氯化鈣 |
| 水中的溶解性 | 可溶于冷水、易溶于熱水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6種 | B. | 8種 | C. | 10種 | D. | 12種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | Al2O3、SiCl4均為共價化合物 | |
| B. | 生產過程中均涉及氧化還原反應 | |
| C. | 石英可用于制光導纖維,晶體Si常用做半導體材料 | |
| D. | 黃銅礦冶煉銅時產生的SO2可用于生產硫酸,FeO可用于冶煉鐵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子數為0.1NA 的N2 和NH3 混合氣體,原子間含有的共用電子對數目為0.3NA | |
| B. | 2 mol SO2 和1 mol O2 在一定條件下充分反應后,所得混合氣體的分子數大于2NA | |
| C. | 1.5 mol NO2 與足量水反應,轉移的電子數為1.5NA | |
| D. | 常溫條件下,分子數為NA 的CO、N2混合氣體質量為28 g |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na202與足量H20反應生成標況下11.2L 02.轉移電子的數目為2NA | |
| B. | 標準狀況下,2.24L S03中所含電子數為4NA | |
| C. | 用惰性電極電解CuS04溶液后,如果加入0.1mol Cu(0H)2能使溶液復原,則電路中轉移電子的數目為0.2NA | |
| D. | 0℃和101kp的條件下,1.12L甲烷完全燃燒生成的水分子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
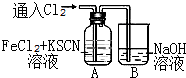 甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,發現A中溶液先呈紅色后逐漸變為黃色.
甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,發現A中溶液先呈紅色后逐漸變為黃色.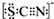 .則碳元素的化合價是+4
.則碳元素的化合價是+4查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com