
【題目】某課外活動小組為了檢驗鈉與水反應的產物,設計如圖裝置(夾持裝置省略).首先在U形管內加入少量煤油和兒粒鈉塊,再從U形管高端加入水(含有酚酞),趕出空氣,一會兒點燃酒精燈加熱銅絲.
根據反應中觀察到的現象,回答下列問題:
(1)反應過程中金屬鈉除了逐漸變小外,還有什么現象? . 請寫出該反應的化學方程式為 .
(2)銅絲的變化現象 , 反應的化學方程式是 .
【答案】
(1)在水和煤油的界面上下跳動;2Na+2H2O=2NaOH+H2↑
(2)由黑色變紅色;CuO+H2 ![]() Cu+H2O
Cu+H2O
【解析】解:(1)密度大于水,小于煤油,反應時在水和煤油界面處上下跳動,反應現象:在水和煤油的界面上作上下跳動且逐漸變小,鈉和水反應生成氫氧化鈉溶液顯堿性,與水發生反應的化學方程式:2Na+2H2O=2NaOH+H2↑,
所以答案是:在水和煤油的界面上下跳動;2Na+2H2O=2NaOH+H2↑;(2)生成的氫氣通過表面有氧化銅的銅絲,氫氣會和氧化銅反應生成銅和水,生成的H2發生反應:CuO+H2 ![]() Cu+H2O,反應現象由黑色變紅色,說明鈉和水反應生成氫氣,所以答案是:由黑色變紅色,CuO+H2
Cu+H2O,反應現象由黑色變紅色,說明鈉和水反應生成氫氣,所以答案是:由黑色變紅色,CuO+H2 ![]() Cu+H2O.
Cu+H2O.
【考點精析】利用鈉的化學性質對題目進行判斷即可得到答案,需要熟知鈉的化學性質:與非金屬反應;與水反應;與酸反應;與鹽溶液反應.


 世紀百通主體課堂小學課時同步達標系列答案
世紀百通主體課堂小學課時同步達標系列答案 世紀百通優練測系列答案
世紀百通優練測系列答案 百分學生作業本題練王系列答案
百分學生作業本題練王系列答案科目:高中化學 來源: 題型:
【題目】某新型燃料電池能以乙烯為原料制備乙醛并獲得電能,工作原理如圖所示。下列說法正確的是
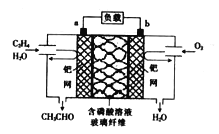
A. a電極為正極
B. 放電時,若有2mol電子轉移,則理論上需要消耗28g乙烯
C. a極的電極反應式為CH2=CH2+2OH--2e-=CH3CHO+H2O
D. 電子移動方向:a電極→磷酸溶液→b電極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列不能用勒夏特列原理解釋的事實是
A. 碳酸鈣不溶于水,但溶于鹽酸
B. 由2NO2(g)![]() N2O4(g)組成的平衡體系,加壓后顏色加深
N2O4(g)組成的平衡體系,加壓后顏色加深
C. 高壓比常壓有利于合成氨的反應
D. 用熱的純堿溶液洗油污時,去污效果好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錳及其化合物在現代工業及國防建設中具有十分重要的意義。回答下列問題:
(1)常用鋁熱法還原軟錳礦(主要成分為MnO2)來制金屬錳。因為鋁與軟錳礦反應劇烈,所以先在強熱條件下將軟錳礦轉變為Mn3O4,然后再將其與鋁粉混合。
①MnO2中Mn的化合價為____________________。
②鋁粉與Mn3O4反應時,還原劑與氧化劑的物質的量之比為_________________。
(2)pH=0的溶液中,不同價態錳的微粒的能量(E)如圖所示。若某種含錳微粒(如Mn3+)的能量處于相鄰價態兩種微粒(Mn2+和MnO2)能量連線的上方,則該該微粒不穩定,會發生歧化反應,轉化為相鄰價態的微粒。

①MnO42-______(填“能”或“不能”)穩定存在于pH=0的溶液中。
②實驗室可利用以下反應檢驗Mn2+的存在:2Mn2++5S2O82-+8H2O==16H++10SO42-+2 MnO42-,確認Mn2+存在的現象是______________________;檢驗時必須控制Mn2+的濃度和用量,否則實驗失敗,理由是___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaBH4是一種棕黃色固體,在酸性條件下易水解放出氫氣,是最常用的還原劑之一,廣泛用于有機合成和電鍍等。一種制取NaBH4的工藝流程如下:

回答下列問題:
(1)步驟①用CH4與H2O(g)反應制H2的同時會生成CO2。0.4 mol CH4完全反應生成H2的物質的量為 __________________mol。
(2)步驟③發生反應的化學方程式為____________________________________。
(3)H3BO3是一元弱酸,其在水中的電離方程式為___________________________。
(4)從CH3ONa回收甲醇的方法是_______________________________。
(5)堿性條件下,NaBH4與CuSO4溶液反應可得到納米銅和NaBO2,則該反應的離子方程式為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列儀器能直接用酒精燈加熱的是( )
①量筒 ②錐形瓶 ③燒杯 ④試管 ⑤燒瓶 ⑥蒸發皿 ⑦坩堝
A. ②③④⑥⑦ B. ③④⑥⑦ C. ④⑥⑦ D. ②④⑦
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com