
某廢水中可能存在的離子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
現取該溶液進行有關實驗,實驗過程及現象如下:

? 下列說法正確的是
A.根據實驗①中的現象可推出,氣體A一定是純凈物,淡黃色沉淀一定是AgBr
B.根據實驗②中的現象可推出,氣體B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+
C.根據實驗③中的現象可推出,氣體C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能確定是否含有SO32-、SO42-
C
【解析】
試題分析:A. 某無色溶液中加入過量的HBr溶液并加熱,產生淡黃色沉淀,則說明可能含有Ag+,發生反應:Ag++Br-=AgBr↓,淡黃色沉淀為AgBr;也可能含有S2一、SO32-,發生反應:2S2一+SO32-+6H+=3S↓+3H2O,淡黃色沉淀為S。產生氣體A,證明含有CO32-、S2一、SO32-中至少1種;B. 溶液A中加入過量的NH4HCO3溶液,得到氣體B為CO2;NH4HCO3溶液顯堿性,所以產生的白色沉淀B可能為Al(OH)3,則原溶液中含有AlO2-,在價過量的HBr時發生反應:4H++ AlO2-= Al3++2H2O;錯誤。C.溶液B中加入過量的Ba(OH)2溶液,產生氣體C,為NH3;反應的方程式為NH4++OH- NH3↑+H2O;沉淀C一定含有BaCO3。發生反應HCO3—+ OH-+Ba2+=BaCO3↓+H2O。若原溶液中含有SO42-,則沉淀C中就含有BaSO4,沉淀反應為SO42-+Ba2+=BaSO4↓.正確。D.根據上述分析可知原溶液一定含有AlO2-,,由于Al3+、AlO2一會發生離子反應而不能共存。因此一定不含有Al3+。但是其它離子如S2-不能確定其存在。錯誤。
NH3↑+H2O;沉淀C一定含有BaCO3。發生反應HCO3—+ OH-+Ba2+=BaCO3↓+H2O。若原溶液中含有SO42-,則沉淀C中就含有BaSO4,沉淀反應為SO42-+Ba2+=BaSO4↓.正確。D.根據上述分析可知原溶液一定含有AlO2-,,由于Al3+、AlO2一會發生離子反應而不能共存。因此一定不含有Al3+。但是其它離子如S2-不能確定其存在。錯誤。
考點:考查離子的鑒定的知識。


科目:高中化學 來源: 題型:閱讀理解
 學校化學研究小組對某溶液進行檢測分析,該無色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等離子中的幾種離子.
學校化學研究小組對某溶液進行檢測分析,該無色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等離子中的幾種離子.

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2012?浙江模擬)學校化學研究小組對某溶液進行檢測分析,該無色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等離子中的幾種離子.
(2012?浙江模擬)學校化學研究小組對某溶液進行檢測分析,該無色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等離子中的幾種離子.

查看答案和解析>>
科目:高中化學 來源: 題型:
 已知某工業廢水中含有N
已知某工業廢水中含有N| O | - 3 |
| ||
|
查看答案和解析>>
科目:高中化學 來源: 題型:
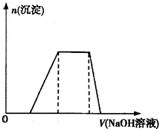
 向某溶液中逐滴加入0.5mol/L的NaOH溶液,生成沉淀的質量與加入NaOH溶液的體積之間的關系如右圖所示,則該溶液中可能存在的離子是
向某溶液中逐滴加入0.5mol/L的NaOH溶液,生成沉淀的質量與加入NaOH溶液的體積之間的關系如右圖所示,則該溶液中可能存在的離子是| A、只有Al2+ | B、有Mg2+和Al3+ | C、有H+、Mg2+和Al3+ | D、有NH4+、Mg2+和Al3+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com