
硫酸亞鐵是重要的亞鐵鹽,在農業上用作農藥,主要治小麥黑穗病,還可以用作除草劑;在工業上用于染色、制造藍黑墨水和木材防腐等。
(1)新制的綠礬(FeSO4·7H2O)是淺綠色的,但在空氣中極易變成黃色或鐵銹色的堿式硫酸鐵[Fe(OH)SO4],寫出該反應的化學方程式:??????????????????????????????????????????????? 。
(2)已知FeSO4在不同條件下分解得到產物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;
SO3熔點是16.8℃,沸點是44.8℃。
某研究性學習小組擬用下列裝置進行實驗探究“在加熱條件下FeSO4的分解產物”。

上述裝置Ⅲ和Ⅳ用來檢驗氣體產物。試回答下列問題:
①Ⅱ裝置燒杯中水的溫度應控制在????? (選填“0℃、25℃、50℃”),裝置Ⅱ的作用是??????????? 。
②裝置Ⅲ中的試劑可以是??????? (選填序號,下同),現象是????????????? ,則證明氣體產物中含有SO2; 裝置Ⅳ中的試劑可以是????????? 。
A. 2 mol/LNa2CO3溶液
B. 品紅溶液
C. 0.5 mol/L BaCl2溶液?
D. 0.5 mol/LBa(NO3)2
E. 0.01 mol/L KMnO4溶液
F. 淀粉碘化鉀溶液
③裝置V中試劑為NaOH溶液,發生反應的離子方程式為??????????????????????????? 。
④為了檢驗固體產物成分,取反應后的固體于試管中,加稀硫酸溶解,將所得溶液分成兩份,進行如
下實驗:
操作步驟 | 預期實驗現象 | 預期實驗結論 |
向其中一份溶液中加入??? ?????????? 。 | ? ????????????????????????? | ????? 固體中含有Fe2O3 |
向另一份溶液中滴加2滴黃色K3[Fe(CN)6]溶液。 | ???????? 產生藍色沉淀 | ?????????????????????????? |
⑤若用22.8 g FeSO4固體做實驗,完全分解后,得到11.2 g固體,其中Fe2O3的質量分數=??????????
(精確到0.1%)
(1)4(FeSO4·7H2O)+ O2= 4Fe(OH)SO4 + 26H2O
(2)① 50℃,防止產生倒吸(或“用作安全瓶”)
② C, 產生白色沉淀, B、E
③ SO2 + 2OHˉ=SO32ˉ+ H2O
④
操作步驟 | 預期實驗現象 | 預期實驗結論 |
KSCN溶液(或硫氰化鉀溶液)? | ????? 溶液變成血紅色 |
|
|
| ???? 固體中含有FeO |
⑤ 35.7%
【解析】
試題分析:(1)Fe2+有還原性,容易被空氣中的氧氣氧化為Fe3+. 根據題意該反應的化學方程式為4(FeSO4·7H2O)+ O2= 4Fe(OH)SO4 + 26H2O。(2)①反應的產物Fe2O3留在試管中,而SO2、SO3則以氣體的形式從試管中出來,若Ⅱ裝置燒杯中水的在0℃、25℃,SO3就會變為固體單質,導致裝置中的氣體壓強變小,而引起倒吸現象的反應。因此Ⅱ裝置溫度應控制在50℃就可以保證SO3的氣態形式。Ⅱ裝置的作用就是防止產生倒吸(或“用作安全瓶”)。 ②無論是哪種分解方式都會產生SO3,SO3溶于水產生硫酸。所以裝置Ⅲ中的試劑可以是C(BaCl2),反應的離子方程式為:Ba2++SO42-=BaSO4↓。會看到產生白色沉淀。若要證明氣體產物中含有SO2,可以利用其漂白性,把氣體通入品紅溶液中,看到品紅溶液褪色;或利用其還原性,把氣體通入到酸性高錳酸鉀溶液。看見溶液的紫色褪去。因此裝置Ⅳ中的試劑可以是B、E。③SO2是大氣污染物,在排放到空氣之前要進行尾氣處理。因為它的水溶液顯酸性,所以常用堿溶液來吸收處理,若裝置V中試劑為NaOH溶液,發生反應的離子方程式為SO2 + 2OHˉ =SO32ˉ+ H2O 。④若固體是Fe2O3,加入硫酸時發生反應:Fe2O3+3H2SO4= Fe2 (SO4) 3+3H2O.產生的Fe3+遇到SCN-溶液時會發生顏色變化產生血紅色的Fe(SCN)3. 若向另一份溶液中滴加2滴黃色K3[Fe(CN)6]溶液,產生藍色沉淀。則證明含有固體中含有FeO。反應的離子方程式為FeO+4H+= Fe2++H2O. 3Fe2++2[Fe(CN)6]3-= Fe3[Fe(CN)6]2 ↓. Fe3[Fe(CN)6]2是藍色難溶性的物質。⑤n (FeSO4)=22.8 g÷152 g/mol =0.15mol., 假設所得固體中Fe2O3的質量為x,FeO質量為y,則x+y=11.2; 2x÷160+ y÷72=0.15解得x=4 ;y-7.2,所以Fe2O3的質量分數為(4÷11.2)×100%=35.7%.
考點:考查Fe2+的性質、離子方程式的書寫、尾氣的處理、Fe2+ 和Fe3+、SO3和SO2的檢驗方法、試劑的選擇與使用及混合物中某成分含量的測定等知識。


科目:高中化學 來源: 題型:
①將5%Na2CO3溶液加入到盛有一定量廢鐵屑的燒杯中,加熱數分鐘,用傾析法除去Na2CO3溶液,然后將廢鐵屑用水洗滌2—3遍;
②向洗滌過的廢鐵屑中加入過量的稀硫酸,控制溫度在50—80 ℃之間至鐵屑耗盡;
③趁熱過濾,將濾液轉入到密閉容器中,靜置、冷卻結晶;
④待結晶完畢后,濾出晶體,用少量冰水洗滌2—3次,再用濾紙將晶體吸干;
⑤將制得的FeSO4·7H2O晶體放在一個小廣口瓶中,密閉保存。
請回答下列問題:
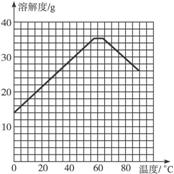
圖6-11
(1)實驗步驟①的目的是______________,加熱的作用是__________________________。
(2)實驗步驟②明顯不合理,理由是_______________________________________。
(3)實驗步驟④中用少量冰水洗滌晶體,其目的是________________;__________________。
(4)經查閱資料后發現,硫酸亞鐵在不同溫度下結晶可分別得到FeSO4·7H2O、FeSO4·4H2O、和FeSO4·H2O。硫酸亞鐵在不同溫度下的溶解度和該溫度下析出晶體的組成如下表所示(僅在57.6 ℃、64 ℃溫度下可同時析出兩種晶體)。
硫酸亞鐵的溶解度和析出晶體的組成
溫度/ ℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.03 | 0.5 | 27 | |
析出晶體 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||||
請根據表中數據作出硫酸亞鐵的溶解度曲線。
(5)若需從硫酸亞鐵溶液中結晶出FeSO4·4H2O,應控制的結晶溫度(t)的范圍為_________。
查看答案和解析>>
科目:高中化學 來源:2010年廈門雙十中學高三考前熱身卷理科綜合(化學) 題型:實驗題
(15分)硫酸亞鐵銨(NH4)2SO4?FeSO4?6H2O是一種重要化學試劑。某探究性學習小組用除去鋅鍍層的鐵片來制取硫酸亞鐵銨,設計流程如下: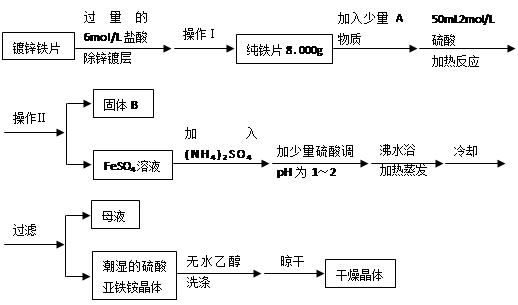
請回答下列問題:
(1)確定鋅鍍層被除去的標志是 ;
計算上述鐵片鋅鍍層的厚度,不需要的數據是 (填編號)。
a.鋅的密度ρ(g/cm3) b.鍍鋅鐵片質量m 1(g) c.純鐵片質量m 2(g)
d.鍍鋅鐵片面積S(cm2) e.鍍鋅鐵片厚度h(cm)
鋅鍍層的厚度為 cm(用含ρ、m 1、m 2…等的代數式表示)。
(2)上述流程中:操作Ⅰ是取出鐵片、 、 、稱量;操作Ⅱ是 。
(3)A物質可以為 (填編號)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物質的目的是 ,B物質的成分為 。
(4)加少量硫酸調節pH為 1~2的目的是 。
(5)用無水乙醇洗滌潮濕的硫酸亞鐵銨晶體是為了除去晶體表面殘留的水分,不用加熱烘干的原因是 。
(6)鑒定所得晶體中含有Fe2+、NH4+、SO42―離子的實驗方法正確的是 (填編號)。
a.取少量樣品于試管,加水溶解,通入適量Cl2,再加KSCN溶液,觀察現象
b.取少量樣品于試管,加水溶解,加入NaOH溶液,露置于空氣中,觀察現象
c.取少量樣品于試管,加水溶解,加入稀NaOH溶液,用濕潤的紅色石蕊試紙置于試管口,觀察試紙顏色的變化
d.取少量樣品于試管,加水溶解,加入鹽酸后再加入BaCl2溶液,觀察現象
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:
硫酸亞鐵銨(NH4)2SO4??FeSO4??6H2O是一種重要化學試劑。某探究性學習小組用除去鋅鍍層的鐵片來制取硫酸亞鐵銨,設計流程如下:

請回答下列問題:
(1)確定鋅鍍層被除去的標志是 ;
計算上述鐵片鋅鍍層的厚度,不需要的數據是 (填編號)。
a.鋅的密度ρ(g/cm3) b.鍍鋅鐵片質量m 1(g) c.純鐵片質量m 2(g)
d.鍍鋅鐵片面積S(cm2) e.鍍鋅鐵片厚度h(cm)
鋅鍍層的厚度為 cm(用含ρ、m 1、m 2…等的代數式表示)。
(2)上述流程中:操作Ⅰ是取出鐵片、 、 、稱量;操作Ⅱ是 。
(3)A物質可以為 (填編號)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物質的目的是 ,B物質的成分為 。
(4)加少量硫酸調節pH為 1~2的目的是 。
(5)用無水乙醇洗滌潮濕的硫酸亞鐵銨晶體是為了除去晶體表面殘留的水分,不用加熱烘干的原因是 。
(6)鑒定所得晶體中含有Fe2+、NH4+、SO42―離子的實驗方法正確的是 (填編號)。
a.取少量樣品于試管,加水溶解,通入適量Cl2,再加KSCN溶液,觀察現象
b.取少量樣品于試管,加水溶解,加入NaOH溶液,露置于空氣中,觀察現象
c.取少量樣品于試管,加水溶解,加入稀NaOH溶液,用濕潤的紅色石蕊試紙置于試管口,觀察試紙顏色的變化
d.取少量樣品于試管,加水溶解,加入鹽酸后再加入BaCl2溶液,觀察現象
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com