
【題目】完成并分析下列化學原理
(1)在配制三氯化鐵溶液時,為了防止發生水解,可以加入少量的________。
(2)把AlCl3溶液蒸干,灼燒,最后得到的主要固體產物是____________;
(3)除去CuCl2溶液中少量的FeCl3,加入的試劑可以是_____________。
(4)在常溫下,稀釋等PH值的HCl、HF兩種酸的稀溶液時,溶液pH隨加水量的變化如圖所示,能表示HF的稀釋過程的曲線是:_____________

(5)amol·L-1(NH4 )2SO4溶液pH=5,其原因是_______(用相應的方程式說明)。
(6)有4種混合溶液,分別由等體積0.1 mol·L-1的兩種溶液混合而成:①NH4Cl與 CH3COONa ②NH4Cl與HCl ③NH4Cl與NaCl ④NH4Cl與NH3·H2O(混合液呈堿性)。溶液中c(H+)由小到大的順序為:(填混合溶液的編號)____________
(7)在做Zn與稀H2SO4反應制取H2的實驗中,向溶液中滴加幾滴CuSO4溶液,反應放出H2速度加快的原因是:__________________________
【答案】稀鹽酸或稀HCl Al2O3 或氧化鋁 氧化銅、氫氧化銅、碳酸銅、堿式碳酸銅 HB NH4+ + H2O![]() NH3·H2O+H+ ④< ①< ③< ② 形成鋅—銅—稀硫酸原電池,加快反應速率
NH3·H2O+H+ ④< ①< ③< ② 形成鋅—銅—稀硫酸原電池,加快反應速率
【解析】
(1)三氯化鐵為強酸弱堿鹽,鐵離子水解呈酸性;
(2)鋁離子水解生成的鹽酸為揮發性酸,蒸干得到氫氧化鋁,再灼燒分解生成氧化鋁;
(3)FeCl3 + 3H2O ![]() Fe(OH)3 + 3HCl,加入的試劑要消耗HCl而使平衡正向移動,使Fe(OH)3 變為沉淀過濾除去,但不能引入新雜質;
Fe(OH)3 + 3HCl,加入的試劑要消耗HCl而使平衡正向移動,使Fe(OH)3 變為沉淀過濾除去,但不能引入新雜質;
(4)稀釋等PH值的HCl、HF兩種酸的稀溶液時,溶液pH變化大的酸性較強,所以HA的酸性強,HB的酸性弱,;
(5)(NH4 )2SO4是強酸弱堿鹽,NH4+水解顯酸性;
(6)酸性越強,pH越小;
(7)形成鋅—銅—稀硫酸原電池,加快反應速率。
(1)三氯化鐵為強酸弱堿鹽,鐵離子水解呈酸性,配制三氯化鐵溶液時,要抑制鐵離子水解,加少量的鹽酸,故答案為:稀鹽酸或稀HCl;
(2)鋁離子水解生成的鹽酸為揮發性酸,蒸干得到氫氧化鋁,再灼燒分解生成氧化鋁,故答案為:Al2O3 或氧化鋁;
(3)FeCl3 + 3H2O ![]() Fe(OH)3 + 3HCl,加入的試劑要消耗HCl而使平衡正向移動,使Fe(OH)3 變為沉淀過濾除去,但不能引入新雜質,故答案為:氧化銅、氫氧化銅、碳酸銅、堿式碳酸銅;
Fe(OH)3 + 3HCl,加入的試劑要消耗HCl而使平衡正向移動,使Fe(OH)3 變為沉淀過濾除去,但不能引入新雜質,故答案為:氧化銅、氫氧化銅、碳酸銅、堿式碳酸銅;
(4)稀釋等PH值的HCl、HF兩種酸的稀溶液時,溶液pH變化大的酸性較強,所以HA的酸性強,表示HF的稀釋過程的曲線是HB;故答案為:HB;
(5)(NH4 )2SO4是強酸弱堿鹽,NH4+水解顯酸性,水解的離子方程式為NH4+ + H2O![]() NH3·H2O+H+,故答案為:NH4+ + H2O
NH3·H2O+H+,故答案為:NH4+ + H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(6)酸性越強,pH越小,四種混合物中,②NH4Cl與HCl的pH最小,④NH4Cl與NH3·H2O的pH最大,①NH4Cl與 CH3COONa顯中性,③NH4Cl與NaCl顯酸性,故pH大小關系為:②<③<①<④,c(H+)=10-PH,c(H+)越大,pH越小,故c(H+)由小到大的順序為④< ①< ③< ②,故答案為:④< ①< ③< ②;
(7)Zn與稀H2SO4反應中滴加幾滴CuSO4溶液,能置換出一定量的銅,在溶液中形成
形成鋅—銅—稀硫酸原電池,加快反應速率,故答案為: 形成鋅—銅—稀硫酸原電池,加快反應速率。


科目:高中化學 來源: 題型:
【題目】從含有CuCl2、FeCl2、FeCl3的工業廢液中回收銅并制備氯化鐵晶體的流程如下:
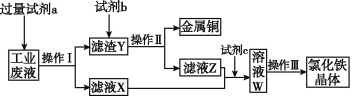
則下列說法正確的是
A. 試劑a是鐵,試劑b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的儀器完全相同
C. 試劑c是氯氣,反應的離子方程式為2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可檢驗溶液W中是否有Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種以石墨和過渡金屬氧化物做電極材料、以固態有機高聚物做電解質溶劑的鋰離子電池,放電時的 總反應方程式為:Li(1-x)CoO2+LixC6=LiCoO2+C6(x<1),其工作原理如圖1所示,圖2是合成有機高聚物的單體的結構簡式。下列說法中,正確的是


A. 放電時,外電路電子由金屬氧化物電極流向石墨電極
B. 充電時,石墨電極作陽極,過渡金屬氧化物作陰極
C. 放電時負極反應為:LiC6-xe-=Li(1-x)C6+xLi+
D. 圖2所示的兩種單體可通過縮聚反應生成有機高聚物溶劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是課外活動小組設計的用化學電源使LED燈發光的裝置。下列說法正確的是
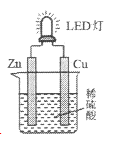
A. 溶液中的SO42-向銅極移動
B. 鋅片為原電池的負極,發生還原反應
C. 如果將稀硫酸換成檸檬汁,導線中不會有電子流動
D. 銅片表面有氣泡生成,發生的反應為:2H++2e-=H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在玻璃圓筒中盛有兩種無色的互不相溶的中性液體。上層液體中插入兩根石墨電極,圓筒內還放有一根下端彎成環狀的玻璃攪棒,可以上下攪動液體,裝置如右圖。接通電源,陽極周圍的液體呈現棕色,且顏色由淺變深,陰極上有氣泡生成。停止通電,取出電極,用攪棒上下劇烈攪動。靜置后液體又分成兩層,下層液體呈紫紅色,上層液體幾乎無色。下列判斷不正確的是( )

A. 原上層液體可能是KI的水溶液,原下層液體可能是CCl4
B. 攪拌后兩層液體顏色發生變化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以絕大部分I2都轉移到CCl4中
C. 陰極區域pH增大的原因是水分子得電子生成了OH—
D. 陽極上的電極反應式2H++2e - =H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y和Z在周期表中的相對位置如圖所示,下列敘述不正確的是
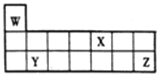
A. 原子半徑:Y>Z>W
B. Z的氧化物對應的水化物酸性均比X的強
C. W、X、Z三種元素形成的化合物可能既含離子鍵又含共價鍵
D. 單質的熔點:Y>X>W
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣(含烴類、CO、NO和SO2等)是空氣的主要污染源。治理方法之一是在汽車排氣管上加裝“催化轉化器”,使CO和NO反應產生可參與大氣循環的無毒氣體,促使烴類充分燃燒及SO2的轉化。下列說法中錯誤的是
A. CO和NO反應生成CO2和N2:2CO+2NO![]() 2CO2+N2
2CO2+N2
B. 汽車改用天然氣為燃料或開發氫能源,都可減少對空氣的污染
C. 此方法的缺點是由于CO2的增多,會大大提高空氣的酸度
D. 增大綠化面積,多植樹造林,可有效控制城市空氣污染
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理(平衡移動原理)解釋的是
A. 對于反應體系 CO(g) + NO2(g) ![]() NO(g) + CO2(g),壓縮體積可使顏色變深
NO(g) + CO2(g),壓縮體積可使顏色變深
B. 實驗室可用排飽和食鹽水的方法收集氯氣
C. 重鉻酸鉀溶液中存在如下平衡:Cr2O72-(橙紅色)+H2O![]() 2H++2CrO42-(黃色),向K2Cr2O7溶液中加入幾滴氫氧化鈉,溶液變黃色
2H++2CrO42-(黃色),向K2Cr2O7溶液中加入幾滴氫氧化鈉,溶液變黃色
D. 開啟啤酒瓶后,瓶中馬上泛起大量泡沫
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金剛石,⑦(NH4)2SO4,⑧乙醇中,由極性鍵形成的非極性分子有_______(填序號,以下同),含有金屬離子的物質是__,分子間可形成氫鍵的物質是________,屬于離子晶體的是__,屬于原子晶體的是__,①~⑤五種物質的熔點由高到低的順序是__。
(2)A,B,C,D為四種晶體,性質如下:
A.固態時能導電,能溶于鹽酸
B.能溶于CS2,不溶于水
C.固態時不導電,液態時能導電,可溶于水
D.固態、液態時均不導電,熔點為3500 ℃
試推斷它們的晶體類型:A.__;B.__;C.__;D.__。
(3)下圖中A~D是中學化學教科書上常見的幾種晶體結構模型,請填寫相應物質的名稱:A.__;B.__;C.__D.____。
.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com