
【題目】將等物質的量的A、B混合于2 L的密閉容器中,發生如下反應:
3A(g)+B(g)![]() xC(g)+2D(g),經5 min后,測得D的濃度為0.5 mol/L,
xC(g)+2D(g),經5 min后,測得D的濃度為0.5 mol/L,
c(A)∶c(B)=3∶5,C的平均反應速率為0.1 mol/(L·min)。求:
(1)此時A的濃度c(A)=________mol/L,反應開始前容器中的A、B的物質的量:n(A)=n(B)=________mol;
(2)B的平均反應速率v(B)=________mol/(L·min);
(3)x的值為________。
 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:
【題目】某課外學習小組對日常生活中不可缺少的調味品M進行探究.已知C可在D中燃燒發出蒼白色火焰.M與其他物質的轉化關系如圖所示(部分產物已略去):
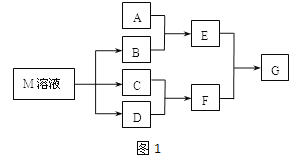
(1)寫出F的電子式 .
(2)若A是一種常見的酸性氧化物,且可用于制造玻璃,E溶液與F溶液反應可以制備一種膠體,則E溶液的俗稱是___________
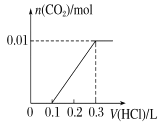
(3)若A是CO2氣體,A與B溶液能夠反應,反應后所得的溶液再與鹽酸反應,如圖所示,則A與B溶液反應后溶液中的溶質化學式為 .
(4)若A是一種常見金屬單質,且A與B溶液能夠反應,則將過量的F溶液逐滴加入E溶液,邊加邊振蕩,所看到的實驗現象是 .
(5)若A是一種化肥.實驗室可用A和B反應制取氣體E,E與F、E與D相遇均冒白煙,且利用E 與D的反應檢驗輸送D的管道是否泄露,寫出E與D反應的化學方程式是 .
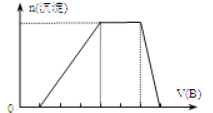
(6)若A是一種溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些離子,當向該溶液中加入B溶液時發現生成沉淀的物質的量隨B溶液的體積發生變化如圖.所示,由此可知,該溶液中肯定含有的離子及其濃度之比為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下, 等體積、等物質的量濃度的鹽酸和醋酸比較,下列說法錯誤的是
A.溶液中pH醋酸比鹽酸大
B.與足量的鋅粉反應產生的氫氣體積相同
C.與足量鋅粒反應時,一開始鹽酸的速率快
D.能中和NaOH溶液的物質的量醋酸較少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素在元素周期表中的位置,反映了元素的原子結構和元素的性質,右圖所示是元素周期表的一部分:

(1)元素N在元素周期表中的位置為第______周期________族。根據元素周期律,請預測H3AsO4、H3PO4的酸性強弱:H3AsO4_________ H3PO4 (填“>”“<”或“=”)。
(2)根據NaH的存在,有人提議可把氫元素放在ⅦA族,那么根據其最高正化合價與最低負化合價的絕對值相等,又可把氫元素放在元素周期表中的________族。
(3)元素甲是第3周期金屬元素中原子半徑最小的元素,該元素的離子與過量的氨水反應的離子方程式為_________________________。
(4)元素周期表中有10多種人體所需的微量元素,其中有一種被譽為“生命元素”的主族元素R,對延長人類壽命起著重要作用。已知R的原子有4個電子層,其最高價氧化物的分子式為RO3,則R的名稱為______(填序號)。
A.硫 B.砷 C.硒 D.硅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在生產生活中有廣泛應用。
(1)已知:CO可將部分氮的氧化物還原為N2。
反應Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1
N2(g)+2CO2(g) △H = -746 kJ·mol-1
反應Ⅱ:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H = -1200 kJ·mol-1
N2(g)+4CO2(g) △H = -1200 kJ·mol-1
寫出CO將NO2還原為NO的熱化學方程式 。
(2)在一絕熱恒容的容器中充入2mol CO和1mol NO2發生上述反應II,以下能說明反應達到平衡狀態的是 ( )
A.容器內的總壓強不在變化 B.容器內CO和NO2物質的量比不變
C.容器內氣體平均密度不變 D.容器內氣體溫度恒定不變
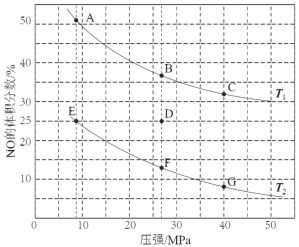
(3)在密閉容器中充入5 mol CO和4 mol NO發生上述反應I,下圖為平衡時NO的體積分數與溫度、壓強的關系。
回答下列問題:
①溫度:T1 T2(填“<”或“>” )。
②某溫度下,在體積為2 L的密閉容器中,反應進行10分鐘放出熱量373 kJ,用CO的濃度變化表示的平均反應速率v(CO)= 。
③若在D點對反應容器升溫的同時擴大體積使體系壓強減小,重新達到的平衡狀態可能是圖中A~G點中的 點
(4)某溫度時,亞硝酸銀AgNO2的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5,當向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-濃度等于1.0×10-5 mol·L-1)時,c(NO2-)= mol·L-1。
(5)如右圖,在酸性條件下,電解水中CN-可轉化為CO2和N2,請寫出陽極的電極反應式 。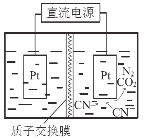
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的沸點由高到低排列的順序是
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3⑤(CH3CH2)2CHCl
A.⑤②④①③ B.④②⑤①③ C.⑤④②①③ D.②④⑤③①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D、E的原子序數依次增大,A和C同族,B和D同族,C離子和B離子具有相同的電子層結構,A和B、D、E均能形成共價型化合物。A和B形成的化合物在水中呈堿性,C和E形成的化合物在水中呈中性.回答下列問題:
(1)五種元素中,原子半徑最大的是 ,非金屬性最強的是 (填元素符號);
(2)由A和B、D、E所形成的共價型化合物中,熱穩定性最差的是____________(用化學式表示);
(3)A和E形成的化合物與A和B形成的化合物反應,產物的電子式為____________;
(4)E的最高價氧化物的水化物的化學式為____________;
(5)單質C在空氣中燃燒的產物存在的化學鍵類型為 ;其反應化學方程式為 ;
(6)單質E與水反應的離子方程式為____________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com