
I、某學生用0.2000 mol·L-1的標準NaOH溶液滴定未知濃度的鹽酸,其操作可分為如下幾步:
①用蒸餾水洗滌堿式滴定管,并注入NaOH溶液至“0”刻度線以上
②固定好滴定管并使滴定管尖嘴充滿液體
③調節液面至“0”或“0”刻度線稍下,并記下讀數
④量取20.00mL待測液注入潔凈的錐形瓶中,并加入3滴酚酞溶液
⑤用標準液滴定至終點,記下滴定管液面讀數
請回答:
(1)以上步驟有錯誤的是(填編號) 。
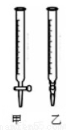
(2)用標準NaOH溶液滴定時,應將標準NaOH溶液注入______中。(從圖中選填“甲”或“乙”)
(3)下列操作會引起實驗結果偏大的是:______(填編號)
A.在錐形瓶裝液前,留有少量蒸餾水
B.滴定前,滴定管尖嘴有氣泡,滴定后無氣泡
C.錐形瓶先用蒸餾水洗滌后,未用待測液潤洗
D.用酸式滴定管量取液體時,釋放液體前滴定管前端有氣泡,之后消失
(4)滴定時,左手控制滴定管,右手搖動錐形瓶,眼睛注視 。判斷到達滴定終點的現象是:錐形瓶中溶液 。
(5)以下是實驗數據記錄表
滴定次數 | 鹽酸體積mL | NaOH溶液體積讀數(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
通過計算可得,該鹽酸濃度為:______ mol•L-1(計算結果保留4位小數)
II、利用間接酸堿滴定法可測定Ba2+的含量,實驗分兩步進行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步驟1:移取x mL一定濃度的Na2CrO4溶液于錐形瓶中,加入酸堿指示劑,用b mol·L-1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0 mL。
步驟2:移取y mL BaCl2溶液于錐形瓶中,加入x mL與步驟:1相同濃度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol·L-1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1 mL。
則BaCl2溶液濃度為______________________ mol·L-1。若步驟2中滴加鹽酸時有少量待測液濺出,則Ba2+濃度的測量值將___________(填“偏大”或“偏小”)。
【答案】I、(1)①④;(2)乙;(3)B;
(4)錐形瓶內顏色;由無色變成淺紅色,且半分鐘內不變色。(5)0.1631;
II、(V0b-V1b)/y ;偏大。
【解析】
試題分析:(1)①根據堿式滴定管在裝液前應用所裝液體進行潤洗,用蒸餾水洗滌堿式滴定管,并立即注入NaOH溶液至“0”刻度線以上,堿式滴定管未用標準氫氧化鈉溶液潤洗就直接注入標準NaOH溶液,標準液的濃度偏小,造成V(標準)偏大,根據c(待測)=V(標準)×c(標準) ÷V(待測),可知c(標準)偏大;④酸堿指示劑酚酞是弱電解質,也會反應消耗酸或堿,為了減少實驗誤差,酚酞一般滴加1滴或2滴,錯誤;其余操作正確;(2)NaOH是堿,容易與玻璃中的SiO2發生反應,所以應該裝在堿式滴定管乙中;(3)A.在錐形瓶裝液前,留有少量蒸餾水,由于不影響酸、堿的物質的量,所以對滴定操作無影響,錯誤;B.滴定前,滴定管尖嘴有氣泡,滴定后無氣泡,使標準溶液體積偏大,導致待測溶液的濃度偏高,正確;C.錐形瓶先用蒸餾水洗滌后,未用待測液潤洗,操作正確,不會產生誤差,錯誤;D.用酸式滴定管量取液體時,釋放液體前滴定管前端有氣泡,之后消失,則待測溶液體積偏少,反應消耗標準酸溶液的體積偏小,使測得濃度偏低,錯誤。(4)滴定時,左手控制滴定管,右手搖動錐形瓶,眼睛注視錐形瓶內顏色;判斷到達滴定終點的現象是:錐形瓶中溶液由無色變成淺紅色,且半分鐘內不變色。(5)酸堿發生中和反應時二者的物質的量相等。根據實驗數據可知,第一次實驗數據誤差太大,舍棄,V(NaOH)= (16.30+16.32)÷2=16.31mL,c(NaOH)·V(NaOH)=c(HCl)·V(HCl),所以c(HCl)=[ c(NaOH)·V(NaOH)]÷V(HCl)= [0.2000 mol·L-1×16.31mL]÷20.00mL=0.1631mol/L;II、根據方程式可知氫離子的物質的量與溶液中Ba2+的物質的量相等。步驟Ⅱ:待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol•L-1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1 mL,則發生2CrO42-+2H+=Cr2O72-+H2O的鹽酸的物質的量為:V1×10-3×bmol,步驟Ⅰ:用b mol•L-1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0 mL,加入的總鹽酸的物質的量:V0×10-3×bmol,Ba2++CrO42-=BaCrO4↓,與Ba2+反應的CrO42-的物質的量為V0×10-3×bmol-V1×10-3×bmol=(V0 -V1)b×10-3mol,步驟Ⅱ:移取y mLBaCl2溶液于錐形瓶中,所以BaCl2溶液的濃度為:(V0 -V1)b×10-3mol ÷y×10?3mol/L=(V0b-V1b)/ymol/L;若步驟Ⅱ中滴加鹽酸時有少量待測液濺出,V1減小,則Ba2+濃度測量值將偏大。
考點:考查酸堿中和滴定的有關知識。
【題型】實驗題
【適用】較難
【標題】【百強校】2015-2016學年陜西西安高新一中高一下期末化學試卷(帶解析)
【關鍵字標簽】
【結束】
氮元素的氫化物和氧化物在工業生產和國防建設中都有廣泛應用,回答下列問題:
(1)已知:2NO2(g)  N2O(g) △H1 2NO2(g)
N2O(g) △H1 2NO2(g)  N2O(l) △H2
N2O(l) △H2
下列能量變化示意圖中,正確的是(選填字母) 。

(2)氨氣和氧氣從145℃就開始反應,在不同溫度和催化劑條件下生成不同產物(如下圖)
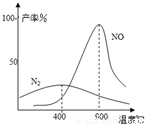
溫度較低時以生成 為主,溫度高于900℃時,NO產率下降的原因是 。
(3)火箭升空需要高能的燃料,經常是用四氧化二氮和聯氨(N2H4)作為燃料,工業上利用氨氣和氫氣可以合成氨氣,氨又可以進一步制備聯氨等。
已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1
NO2(g)  1/2 N2O4(g) △H=-26.35kJ•mol-1
1/2 N2O4(g) △H=-26.35kJ•mol-1
①寫出氣態聯氨在氣態四氧化二氮中燃燒生成氮氣和水蒸氣的熱化學方程式: 。
②用氨和次氯酸鈉按一定物質的量之比混合反應可生成聯氨,該反應的化學方程式為 。
 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源:2015-2016學年江西省高二下學期期末考試化學試卷(解析版) 題型:推斷題
A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B的相對分子質量都不超過200,完全燃燒都只生成CO2和H2O。且B分子中碳和氫元素總的質量分數為65.2%。A溶液具有酸性,不能使FeCl3溶液顯色。
(1)A、B的相對分子質量之差為 。
(2)1個B分子中應該有 個氧原子。
(3)A中所含的官能團名稱: 。
(4)1molB物質分別與足量的碳酸氫鈉溶液、氫氧化鈉溶液反應理論上消耗二者的物質的量之比是 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省懷化市高一下學期期末考試化學試卷(解析版) 題型:選擇題
已知反應A+B=C+D的能量變化如圖所示,下列說法正確的是
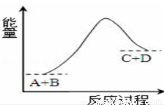
A.該反應只有在加熱條件下才能進行
B.該反應為吸熱反應
C.該反應為放熱反應
D.反應物的總能量高于生成物的總能量
查看答案和解析>>
科目:高中化學 來源:2015-2016學年重慶一中高一下期末化學試卷(解析版) 題型:選擇題
根據碘與氫氣反應的熱化學方程式,下列判斷正確的是
(i)H2(g)+I2(g)==2HI(g);△H=-9.48kJ/mol
(ii)H2(g)+I2(s)==2HI(g);△H=+26.48kJ
A.1mol I2(g)中通入2(g)H2(g),反應放熱9.48kJ
B.1mol I2(s)升華,吸熱17.00kJ
C.反應(i)的產物比反應(ii)的產物穩定
D.反應(ii)的反應物總能量比反應(i)的反應物總能量低
查看答案和解析>>
科目:高中化學 來源:2015-2016學年重慶一中高一下期末化學試卷(解析版) 題型:選擇題
某無色溶液中含有大量的H+和SO42-,則此溶液還能大量存在的離子組是
A.Na+、Fe2+、NO3- B.Na+、Mg2+、NO3-
C.Cr2O72-、Ba2+、Cl- D.K+、Na+、S2O32-
查看答案和解析>>
科目:高中化學 來源:2015-2016學年陜西西安高新一中高一下期末化學試卷(解析版) 題型:推斷題
氣相直接水合法制乙醇的方程式為:C2H4 (g)+H2O(g)=C2H5OH(g),其中乙烯的平衡轉化率與溫度、壓強的關系如圖[起始n(H2O)︰n(C2H4)=1︰1]。
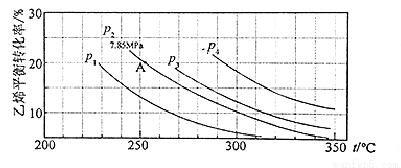
計算乙烯水合制乙醇反應在圖中A點的平衡常數KP為(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
A.0.068 MPa-1 B.0.082 C.0.072 MPa-1 D.0.082 MPa-1
【答案】C
【解析】
試題分析:由圖可知,A點乙烯的平衡轉化率為20%,設起始量n(H2O)=n(C2H4)=1mol,轉化的乙烯為0.2mol,則: C2H4 (g)+H2O(g)=C2H5OH(g)
起始量(mol):1 1 0
轉化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.8 0.2
壓強之比等于物質的量之比,則p(C2H4)=p(H2O)=7.8MPa×(0.8mol÷1.8mol)=7.8MPa×4/9,p(C2H5OH)=7.8MPa×1/9,則Kp=p(C2H5OH)/[p(C2H4)×p(H2O)]=(7.8MPa×1/9)7.8MPa×4/9×7.8MPa×4/9 =0.072MPa-1,選項C正確。
考點:考查圖像方法在化學平衡計算的應用的知識。
【題型】選擇題
【適用】較難
【標題】【百強校】2015-2016學年陜西西安高新一中高一下期末化學試卷(帶解析)
【關鍵字標簽】
【結束】
X、Y、Z、J、Q五種短周期主族元素,原子序數依次增大,元素Z在地殼中含量最高,J元素的焰色反應呈黃色,Q的最外層電子數與其電子總數比為3:8,X能與J形成離子化合物,且J+的半徑大于X-的半徑,Y2是空氣的主要成分之一。請回答:
(1)Q元素在周期表中的位置_______________________;
(2)這五種元素原子半徑從大到小的順序為_____________________________(填元素符號)。
(3)元素的非金屬性Z____Q(填“>”或“<”),下列各項中,不能說明這一結論的事實有 (填序號)
A.Q的氫化物的水溶液放置在空氣中會變渾濁 |
B.Z與Q之間形成的化合物中元素的化合價 |
C.Z和Q的單質的狀態 |
D.Z和Q在周期表中的位置 |
(4)X與Y可形成簡單分子A,寫出A的電子式_______________;實驗室制備氣體A的化學方程式 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年陜西西安高新一中高一下期末化學試卷(解析版) 題型:選擇題
下列結論正確的是
①粒子半徑:K+>Al3+>S2->Cl-
②氫化物的穩定性:HF>HCl>H2S>PH3>SiH4
③離子的還原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金屬性:O>N>P>Si
⑦金屬性:Be<Mg<Ca<K
A. ②⑤⑦ B. ②⑥⑦ C. ②④⑤⑥⑦ D. ②④⑥
【答案】C
【解析】試題分析:①電子層結構相同,核電荷數越大離子半徑越小,電子層越多離子半徑越大,故離子半徑S2->Cl->K+>Al3+,錯誤;②非金屬性F>Cl>S>P>Si,氫化物穩定性:HF>HCl>H2S>PH3>SiH4,正確;③非金屬性Cl>Br>I>S,陰離子還原性S2->I->Br->Cl-,錯誤;④非金屬性Cl>S>Se>Te,單質氧化性Cl2>S>Se>Te,正確;⑤非金屬性S>P>C,最高價含氧酸的酸性H2SO4>H3PO4>H2CO3,碳酸的酸性比HClO強,故酸性H2SO4>H3PO4>H2CO3>HClO,正確;⑥同周期隨原子序數增大元素非金屬性增強,同主族自上而下元素非金屬性減弱,故非金屬性O>N>P>Si,正確;⑦同主族自上而下金屬性增強,同周期自左而右金屬性減弱,故金屬性:Be<Mg<Ca<K,正確。正確的判斷是②④⑤⑥⑦ ,選項C符合題意。
考點:考查微粒半徑比較、氧化性及還原性強弱比較及同周期、同主族元素金屬性非金屬性強弱比較的知識。
【題型】選擇題
【適用】一般
【標題】【百強校】2015-2016學年陜西西安高新一中高一下期末化學試卷(帶解析)
【關鍵字標簽】
【結束】
下列圖示與對應的敘述相符的是
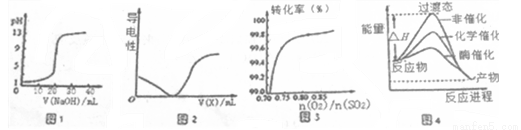
A.圖一表示0.1000mol·L-1NaOH溶液滴定20.00ml 0.1000 mol·L-1醋酸溶液得到滴定曲線
B.圖2所示在H2S溶液導電性實驗中,曲線可確定通入的氣體X為Cl2
C.圖3在其它條件不變時,2SO2(g)+O2(g)  2SO3(g)轉化關系中,縱坐標表示O2的轉化率
2SO3(g)轉化關系中,縱坐標表示O2的轉化率
D.由圖4所示曲線可知,酶催化比化學催化的效果好
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省高一下期末化學試卷(解析版) 題型:填空題
下表為元素周期表的一部分,請參照元素①~⑧在表中的位置,用化學用語回答下列問題:

(1)⑨的原子結構示意圖為 。
(2)②的氣態氫化物分子的結構式為 ⑧的最高價氧化物的水化物的分子式 。
(3)②、③的最高價含氧酸的酸性由強到弱的順序是 。(填化學式)
(4)⑤、⑥元素的金屬性強弱依次 。(填“增大”、“減小”或“不變”)
(5)④、⑤、⑥形成的簡單離子半徑依次 。(填“增大”、“減小”或“不變”)
(6)①、④、⑤元素可形成既含離子鍵又含共價鍵的化合物,寫出它的電子式 。
(7)⑤、⑥、⑨的最高價氧化物對應水化物兩兩均能反應,寫出其反應的離子方程式。 、 、 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年海南瓊海嘉積中學高一下期末文科化學試卷(解析版) 題型:選擇題
下列工藝屬于物理過程的是( )
A.煤的干餾 B.煤的氣化 C.石油分餾 D.石油裂化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com