
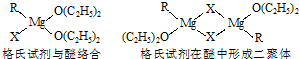
| ||
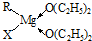 、
、 ,
,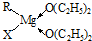 、
、 ;
;| 1 |
| 6 |
| 1 |
| 2 |


 口算小狀元口算速算天天練系列答案
口算小狀元口算速算天天練系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 (2013?遼寧一模)[化學--選修3物質結構與性質]
(2013?遼寧一模)[化學--選修3物質結構與性質]| 417×1030 |
| a3NA |
| 417×1030 |
| a3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 元素 | A | B | C |
| 結構信息 | 基態原子核外有兩個電子層,最外層有3個未成對的電子 | 基態原子的M層有1對成對的p電子 | 基態原子核外電子排布為[Ar]3d104sx,有+1、+2兩種常見化合價 |
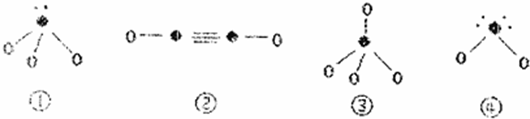
查看答案和解析>>
科目:高中化學 來源: 題型:
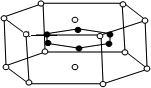
 [化學-選修物質結構與性質]現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖所示的結構或結構單元(圖形以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同,單質A的同素異形體能與B物質發生置換反應.C、D、E、F含有相同的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.
[化學-選修物質結構與性質]現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖所示的結構或結構單元(圖形以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同,單質A的同素異形體能與B物質發生置換反應.C、D、E、F含有相同的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.查看答案和解析>>
科目:高中化學 來源: 題型:
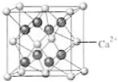 (4)B與Ca形成的晶體的晶胞如右圖所示,其中Ca2+的配位數是
(4)B與Ca形成的晶體的晶胞如右圖所示,其中Ca2+的配位數是查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com