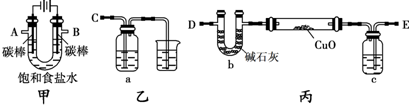
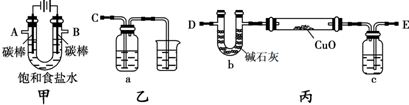
解:(1)電解飽和食鹽水陽極是氯離子失電子發生氧化反應生成氯氣,陰極是氫離子得到電子發生還原反應,生成氫氣,反應的化學方程式為:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,
故答案為:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑;
(2)裝置圖分析可知,電解飽和食鹽水陽極B是氯離子失電子發生氧化反應生成氯氣,陰極A是氫離子得到電子發生還原反應,生成氫氣,電解產生的H
2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性,裝置丙中的E接電解裝置中的A;裝置乙是驗證氯氣氧化性的裝置,C接電解池的B電極,
故答案為:E;C;
(3)氫氣還原氧化銅加熱前需要通入氫氣把空氣趕出,避免空氣存在加熱發生爆炸,裝置中充滿氫氣在D處檢驗氫氣的純度,
故答案為:先通一段時間氫氣并在D處檢驗氫氣的純度;
(4)檢驗氯氣的氧化性可以利用還原性的物質發生反應,且有明顯的現象,可以把氯氣通入淀粉碘化鉀溶液發生氧化還原反應,生成碘單質遇淀粉變藍;多余的氯氣是污染性氣體需要用氫氧化鈉溶液進行吸收處理,反應的離子方程式為:Cl
2+2OH
-=Cl
-+ClO
-+H
2O,
故答案為:淀粉KI溶液;溶液變為藍色;Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
(5)因為乙方案是測水的質量,氫氣中含有水蒸氣,通入玻璃管會炸裂玻璃管,需要進行干燥,可以通過濃硫酸吸收水蒸氣,
故答案為:濃硫酸;吸收H
2中的H
2O,防止硬質玻璃管炸裂,或影響測定水的質量;
(6)①甲方案是利用反應前后固體物質質量的變化進行計算,乙方案是測定水的質量減小計算,裝置D會吸收空氣中的水蒸氣和二氧化碳使測定結果偏高,
故答案為:甲;空氣中的CO
2和H
2O通過D口進入U形管造成實驗誤差較大;
②精確測量硬質玻璃管的質量為ag,放入CuO后,精確測量硬質玻璃管和CuO的總質量為bg,氧化銅質量=(b-a)g,通過精確測量硬質玻璃管和Cu粉的總質量為c g,銅元素質量=(c-a)g,所以氧元素質量=(b-c)g,設銅相對原子質量為M(Cu),則

=
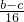
,得到M(Cu)=

,故答案為:

.
分析:(1)電解飽和食鹽水陽極是氯離子失電子發生氧化反應生成氯氣,陰極是氫離子得到電子發生還原反應,生成氫氣,結合產物書寫化學方程式;
(2)依據裝置圖分析可知,電解飽和食鹽水陽極B是氯離子失電子發生氧化反應生成氯氣,陰極A是氫離子得到電子發生還原反應,生成氫氣,電解產生的H
2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性,裝置丙中的E接電解裝置中的A;裝置乙是驗證氯氣氧化性的裝置,D接電解池的B電極;
(3)氫氣還原氧化銅加熱前需要通入氫氣把空氣趕出,避免空氣存在加熱發生爆炸,裝置中充滿氫氣在D處檢驗氫氣的純度;
(4)檢驗氯氣的氧化性可以利用還原性的物質發生反應,且有明顯的現象,可以把氯氣通入淀粉碘化鉀溶液發生氧化還原反應,生成碘單質遇淀粉變藍;氯氣需要用氫氧化鈉溶液吸收;
(5)氫氣中含有水蒸氣,通入玻璃管會炸裂玻璃管,需要進行干燥,可以通過濃硫酸吸收水蒸氣;
(6)①甲方案是利用反應前后固體物質質量的變化進行計算,乙方案是測定水的質量減小計算,裝置D會吸收空氣中的水蒸氣和二氧化碳使測定結果偏高;
②依據甲方案實驗數據,利用氧化銅中銅元素物質的量和氧元素物質的量之比等于1:1計算得到銅的相對原子質量.
點評:本題考查了物質性質的驗證和物質測定實驗設計方案,物質性質的掌握,實驗步驟和實驗原理的理解是解題關鍵,題目難度中等.

 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑; =
=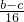 ,得到M(Cu)=
,得到M(Cu)= ,故答案為:
,故答案為: .
.

 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案 某化學小組擬采用如下裝置(夾持和加熱儀器已略去)來電解飽和食鹽水,并用電解產生的H2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性.
某化學小組擬采用如下裝置(夾持和加熱儀器已略去)來電解飽和食鹽水,并用電解產生的H2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性.