
【題目】常溫下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計)。下列敘述一定正確的是
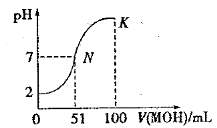
A.由圖中信息可知HA為弱酸
B.在N點pH=7,酸堿恰好完全反應
C.常溫時一定濃度的MA稀溶液顯中性
D.K 點對應的溶液中,c(M+) + c(MOH)=2c (A-)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】如圖的各方框表示一種反應物或生成物(某些物質已經略去),其中常溫下A、C、D為無色氣體,C能使濕潤的紅色石蕊試紙變藍。
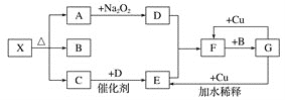
(1)寫出物質X的化學式:__。
(2)寫出下列變化的化學方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)實驗室里,常用加熱固體混合物的方法制取氣體C,請寫出化學方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖表示滲透作用裝置圖,其中半透膜為膀胱膜,甲、丙裝置中A、B、a、b溶液濃度分別用MA、MB、Ma、Mb表示,乙、丁裝置分別表示一段時間后甲、丙裝置的狀態,液面上升的高度分別為h1、h2。如果A、B、a、b均為蔗糖溶液,且MA>MB,Ma=Mb>MA,則達到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z為短周期原子序數依次增大的主族元素,其原子序數之和為30,W與X、Y、Z都能形成共價化合物,Y、W形成的常見化合物溶于水顯堿性,Z、W形成的化合物溶于水顯酸性,四種元素形成的某種化合物的結構式為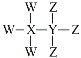 。下列說法錯誤的是
。下列說法錯誤的是
A.X為硼元素或碳元素
B.Y不屬于第ⅣA族元素
C.W與Y、Z分別形成的常見化合物能反應生成鹽
D.最高價氧化物對應的水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表列出了某短周期元素R的各級電離能數據(用I1、I2……表示,單位為kJ·mol-1)

下列關于元素R的判斷中一定正確的是( )
A. R的最高正價為+3價
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外層共有4個電子
D. R元素基態原子的電子排布式為1s22s2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸亞鐵晶體([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸與FeCO3反應制得,它易溶于水,是一種很好的補鐵劑。
Ⅰ.制備碳酸亞鐵(裝置如圖所示)
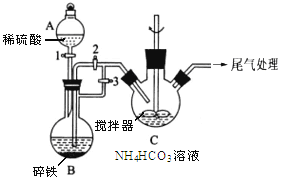
(1)儀器A的名稱是______________ ;
(2)實驗操作如下:關閉活塞2,打開活塞1、3,加入適量稀硫酸反應一段時間,其目的是___________________________________________________________;然后關閉活塞1,接下來的操作是_______________; 裝置C中發生反應的離子方程式為______________ 。
Ⅱ.制備乳酸亞鐵
向純凈的FeCO3固體中加入足量乳酸溶液,在75℃下攪拌使之充分反應。
(3)為防止乳酸亞鐵變質,在上述體系中還應加入____________________________________________________________________________
(4)為證明乳酸亞鐵中含有Fe2+,選擇的檢驗試劑為_______________________________________________________________________;
Ⅲ. 乳酸亞鐵晶體純度的測量
經過過濾、隔絕空氣低溫蒸發、冷卻結晶、過濾、洗滌、干燥等操作,獲得乳酸亞鐵晶體后
(5)兩位同學分別用不同的方案進行測定:
①甲同學通過KMnO4滴定法測定樣品中Fe2+的含量計算樣品純度,所得純度總是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同學經查閱文獻后改用(NH4)4Ce(SO4)4滴定法測定樣品中Fe2+的含量計算樣品純度(反應中Ce4+被還原為Ce3+),稱取6.00g樣品配成250.00mL溶液,取25mL,用0.1 molL—1(NH4)4Ce(SO4)4標準溶液滴定至終點,消耗標準液20.00mL。則產品中乳酸亞鐵晶體的純度為_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu3N具有良好的電學和光學性能,在電子工業領城、航空航天領域、國防領域、通訊領域以及光學工業等領域中,發揮著廣泛的、不可替代的作用。
(1)Cu+的核外電子排布式為__________;N元素與O元素的第一電離能比較:N____O(填“>”、“<”或“=”)。
(2)與N3-含有相同電子數的四原子分子的空間構型為____________________。
(3)在Cu催化作用下,乙醇可被空氣氧化為乙醛(CH3CHO),乙醛分子中醛其(![]() )碳原子的雜化方式為_________。
)碳原子的雜化方式為_________。
(4)[Cu(H2O)4]2+為平面正方形結構,其中的兩個H2O被C1-取代可生成Cu(H2O)2Cl2,試畫出其具有極性的分子的結構式________________。
(5)Cu3N的晶胞結構如圖所示,N3-的配位數為________;若晶胞棱長為anm,NA表示阿伏加德羅常數的值,則Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】茶葉中含有多種有益于人體健康的有機成分及鈣、鐵等微量金屬元素,某化學研究性學習小組設計方案用以檢驗某品牌茶葉中鐵元素的存在并測定鈣元素的質量分數(已知CaC2O4為白色沉淀物質)。首先取200g茶葉樣品進行如圖操作:
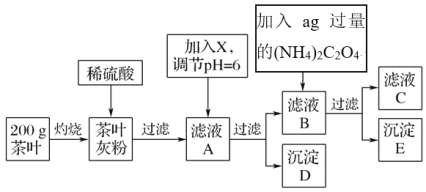
已知:①文獻資料顯示:某些金屬離子的氫氧化物完全沉淀時的pH為:Ca(OH)2:13,Fe(OH)3:4.1
②(NH4)2C2O4溶液顯酸性。
(1)實驗前要先將茶葉樣品高溫灼燒為灰粉,需要用到的實驗儀器有酒精燈、三腳架、玻璃棒、泥三角________,其主要目的是___________________。
A.蒸發皿 B.坩堝C.石棉網
(2)從濾液A→沉淀D的過程中需要加入的物質X可以選擇________。
A.CaO B.Ca(OH)2C.NH3·H2O
(3)用酸性KMnO4標準溶液滴定濾液C時發生的反應為:5C2O42-+2MnO4-+16H+===10CO2↑+2Mn2++8H2O。將濾液C稀釋至250mL,取25.00mL溶液,用硫酸酸化后,用0.10mol·L-1的KMnO4標準溶液滴定,終點時消耗KMnO4溶液體積如表所示:
編號 | KMnO4溶液體積/mL |
1 | 19.98 |
2 | 22.00 |
3 | 20.02 |
①此步操作過程中需要用到圖示中哪些儀器________
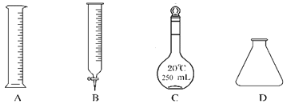
②滴定達到終點時的現象是__________________________。
③為保證實驗精確度,沉淀D及E需要分別洗滌,并將洗滌液轉移回母液中,若不洗滌沉淀D,會使測定的鈣元素的含量________(偏低、偏高、無影響,下同),若不洗滌沉淀E,會使測定的鈣元素的含量________。
④原茶葉中鈣元素的質量分數為________。(用含a的代數式表示,已知(NH4)2C2O4的摩爾質量為124g·mol-1)。
(4)可以通過檢驗濾液A來驗證該品牌茶葉中是否含有鐵元素,所加試劑及實驗現象是_______________、________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一瓶氣體為NH3,氣體的物質的量為0.2mol。
①氣體的質量為______,氣體中含氫原子的物質的量為____ mol。
②氣體中所含分子數為_____。
③氣體在標準狀況下的體積為______。
④將氣體甲完全溶解于水中形成500mL溶液,所得溶液溶質的物質的量濃度為______ molL-1。
⑤將④中所得溶液取出100mL,加水稀釋至1000ml,所得溶液溶質的物質的量濃度為 ______ molL-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com