
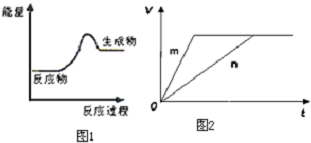
分析 (1)圖1為生成物能量大于反應物能量,則該反應為吸熱反應,根據是否有化合價變化判斷是否為氧化還原反應;
(2)能設計成原電池的反應通常是放熱反應,依據原電池原理可知必須是氧化還原反應;
①發生氧化反應的為負極,發生還原反應的為正極;
②依據電子轉移守恒計算和分析兩個電極變化;
(3)對于反應B,將足量且等量的形狀相同的鋅塊分別加入到等濃度等體積的兩份稀硫酸X、Y中,同時向X中加入少量飽和CuS04溶液,鋅將銅置換出來與鋅形成原電池加快反應速率,所以反應快的為X,據此分析.
解答 解:(1)由圖1為生成物能量大于反應物能量,則該反應為吸熱反應,有化合價變化的是為氧化還原反應,則只有C為吸熱的氧化還原反應,故選:C;
(2)設計原電池需要反應發生的是氧化還原反應,原電池的反應通常是放熱反應,比較分析可知AD為非氧化還原反應,B為放熱反應的氧化還原反應,C為吸熱反應的氧化還原反應,所以B符合原電池設計原理的要求,故答案為:B.
①由原電池總反應Zn+H2SO4═ZnSO4+H2↑,其中負極材料是鋅,發生氧化反應,溶液中氫離子得到電子在正極生成氫氣,電極反應2H++2e-=H2↑,故答案為:鋅;氧化;2H++2e-=H2↑;
②當導線中有1mol電子通過時,負極鋅物質的量減小0.5mol,質量減小0.5mol×65g/mol=32.5g;正極上放出氫氣,根據電子守恒生成氫氣的物質的量0.5mol,質量為0.5mol×2g/mol=1g,所以選項中bc正確;
故答案為:bc;
(3)對于反應B,將足量且等量的形狀相同的鋅塊分別加入到等濃度等體積的兩份稀硫酸X、Y中,同時向X中加入少量飽和CuS04溶液,鋅將銅置換出來與鋅形成原電池加快反應速率,所以反應快的為X,則m曲線到達平衡的時間短,反應速率快,所以m曲線表示鋅與稀硫酸X,故答案為:①X ②c.
點評 本題考查了原電池的設計、原理的分析和應用,主要是電極反應及其相關計算,電極產物判斷,掌握基礎是關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 位于第四周期第IA族 | |
| B. | 能形成穩定的R2+離子 | |
| C. | 在化學反應中,首先失去3d上的電子 | |
| D. | 原子序數為28 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用醋酸鈉晶體和堿石灰共熱制甲烷 | |
| B. | 將鐵屑、溴水、苯混合制溴苯 | |
| C. | 在苯酚溶液中滴人少量稀溴水出現白色沉淀 | |
| D. | 將銅絲在酒精燈上加熱后,立即伸入無水乙醇中,銅絲恢復成原來的紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+、Ca2+、HCO3-、NO3- | B. | Na+、Mg2+、NO3-、CH3COO- | ||
| C. | MnO4-、Na+、K+、SO42- | D. | SO42-、Cl-、K+、Ba2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com