
【題目】(1)Fe2O3+2Al![]() 2Fe+Al2O3 所屬基本反應類型是_______________。
2Fe+Al2O3 所屬基本反應類型是_______________。
(2)在該反應中_______(填寫元素名稱)元素的化合價升高,該元素的原子______電子,被________;而_______(填寫元素名稱)元素的化合價降低,該元素的原子_______電子,被_________。
(3)該反應中,Fe2O3發生了_______反應,Al發生了________反應,_______是氧化劑_________________是還原劑,__________是氧化產物,________是還原產物。
【答案】置換反應 鋁 失去 氧化 鐵 得到 還原 還原 氧化 Fe2O3 Al Al2O3 Fe
【解析】
Fe2O3+2Al![]() Al2O3+2Fe中,Fe元素的化合價降低,Al元素的化合價升高,結合氧化還原反應基本概念以及置換反應的定義來解答即可。
Al2O3+2Fe中,Fe元素的化合價降低,Al元素的化合價升高,結合氧化還原反應基本概念以及置換反應的定義來解答即可。
(1)此反應為一種單質與一種化合物生成另外一種單質與另一種化合物的反應,因此所屬基本反應類型是置換反應;
(2)在該反應中,Al元素的化合價由反應前單質Al的0價變為反應后Al2O3中的+3價,化合價升高,該元素的原子失電子,被氧化,得到的Al2O3是氧化產物;而Fe元素的化合價由反應前Fe2O3中的+3價變為反應后Fe單質的0價,化合價降低,該元素的原子得到電子,被還原,生成的Fe是還原產物;
(3)該反應中,Fe2O3作氧化劑,發生了還原反應,Al作還原劑,Al發生了氧化反應,Al2O3是氧化產物,Fe是還原產物 。


科目:高中化學 來源: 題型:
【題目】在某一恒溫體積可變的密閉容器中發生如下反應:A(g)+B(g)![]() 2C(g)△H<0,t1時刻達到平衡后,在t2時刻改變某一條件,其反應過程(I、Ⅱ)如圖所示。下列說法中不正確的是
2C(g)△H<0,t1時刻達到平衡后,在t2時刻改變某一條件,其反應過程(I、Ⅱ)如圖所示。下列說法中不正確的是

A. t0~t1時,v(正)>v(逆)
B. I、Ⅱ兩過程分別達到平衡時,A的體積分數Ⅰ=Ⅱ
C. t2 時刻改變的條件可能是向密閉容器中加A物質
D. Ⅰ、Ⅱ兩過程達到平衡時,平衡常數Ⅰ=Ⅱ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖表示一些晶體中的某些結構,它們分別是NaCl、CsCl、干冰、金剛石、石墨結構中的某一種的某一部分。
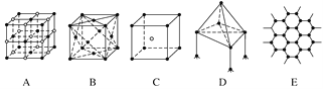
(1)其中代表金剛石的是(填編號字母,下同)____,其中每個碳原子與______個碳原子最接近且距離相等。金剛石屬于________晶體。
(2)其中代表NaCl的是________,每個Na+周圍與它最接近且距離相等的Na+有________個。
(3)代表干冰的是________,它屬于________晶體,每個CO2分子與______個CO2分子緊鄰。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Al、Cl、Cr、Ni等及其相關化合物用途非常廣泛。回答下列問題:
(1)基態鉻原子的價電子排布式為______。
(2)與硅原子未成對電子數相同的第四周期元素共有______種;鈉與鋁處于同周期,鋁的熔沸點及硬度均比鈉大,其原因是______。
(3)KAlO2在水溶液中實際上都是以K[Al(OH)4]形式存在。其中[Al(OH)4]-配離子,中心原子的雜化類型是____。該K[Al(OH)4]物質中存在的化學鍵有配位健、_____(填字母代號)。
A.離子鍵 B.極性鍵 C.非極性鍵 D.金屬鍵 E.氫鍵
(4)CN2稱為氰氣,其性質與鹵素單質相似。與氫氧化鈉溶液反應產物之一為NaCN,寫出兩種與CN-互為等電子體的分子_____,N元素及與其同周期相鄰的兩種元素第一電離能由大到小的順序為______。(填元素符號)
(5)氯化銫熔點:645℃,沸點:1290℃;氯化鋁熔點:190℃,在180℃時開始升華,造成二者熔、沸點相差較大的原因是______;下圖為氯化銫晶胞,已知氯離子半徑為anm,銫離子半徑為bnm,則氯化銫晶體密度為_____g·cm-3(用a、b和阿伏加德羅常數NA的代數式表式,列出算式即可)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】表中原子化熱、晶格能、鍵能的單位都是kJmol﹣1

則下列說法正確的是
A. Na(s)與Cl2(g)反應生成1mol NaCl(s)放出的熱量為556.1kJ
B. Si(s)+2Cl2(g)═SiCl4(g)△H=﹣602kJmol﹣1
C. 從表中可以看出,氯化鈉的熔點比晶體硅高
D. 從表中數據可以看出,微粒半徑越大金屬鍵、離子鍵越弱,而共價鍵卻越強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化硅晶體是立體的網狀結構。其晶體模型如下圖所示。請認真觀察該晶體模型后回答以下問題:

二氧化硅的晶胞結構
(1)二氧化硅晶體中最小環為________元環。
(2)每個硅原子為________個最小環共有。
(3)每個最小環平均擁有________個硅原子、________個氧原子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液可能含有Na+、Ca2+、NO、CO![]() 、SO
、SO![]() 、Cl-等離子。為了鑒別這些離子,分別取少量溶液進行以下實驗:
、Cl-等離子。為了鑒別這些離子,分別取少量溶液進行以下實驗:
①加稀鹽酸后,生成無色無味的氣體,該氣體能使澄清石灰水變渾濁。
②加足量的BaCl2產生白色沉淀,過濾,在沉淀中加入足量的鹽酸,沉淀不能完全溶解。
③取②中濾液,加硝酸酸化后,再加過量的AgNO3溶液,析出白色沉淀。
(1)上述3個實驗證明一定存在的離子是__________,一定不存在的離子是________,可能存在的離子為_______________。
(2)寫出①中涉及反應的離子反應方程式: _____________________________。
(3)實驗室中常用于檢驗Na+是否存在的方法叫___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3)可用作分析試劑、基準試劑、還原劑、除氯劑等。
Ⅰ、實驗室制備硫代硫酸鈉裝置圖如下。

(1)儀器B的名稱是________。
(2)寫出裝置B制備Na2S2O3的化學反應方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、測硫代硫酸鈉樣品純度步驟如下
①稱取Ⅰ中制得硫代硫酸鈉樣品8.0g配成250mL溶液
②從①中量取20.00mL溶液于錐形瓶中
③用0.lmol·L-1標準碘液滴定,實驗測得數據如下
滴定前讀數(mL) | 滴定后讀數(mL) | 待測液體積(mL) | |
實驗一 | 1.20 | 21.00 | 20.00 |
實驗二 | 0.40 | 19.20 | 20.00 |
實驗三 | 0.50 | x | 20.00 |
(4)該滴定時,向錐形瓶中加入1至2滴淀粉液作指示劑,則達到滴定終點的判斷標準是______________。
(5)x讀數如圖所示,則x=________,根據所測的數據計算該硫代硫酸鈉樣品純度為_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)

(6)若步驟①中量取20.00mL硫代硫酸鈉溶液時,未用硫代硫酸鈉溶液潤洗滴定管,則測得樣品的純度將______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗、現象與結論正確且相符的是( )
實驗 | 現象 | 結論 | |
A | 向盛有H2O2溶液的試管中加入幾滴酸化的硫酸亞鐵溶液 | 溶液變成棕黃色,一段時間后,溶液中出現氣泡,隨后有紅褐色沉淀生成 | Fe2+催化H2O2分解產生O2;H2O2分解反應放熱,促進Fe3+的水解平衡正向移動 |
B | 將充滿NO2的密閉玻璃球浸泡在熱水中 | 紅棕色變深 | 反應: 2NO2 (g) |
C | SO2通入新制氯水 | 溶液褪色 | SO2具有漂白性 |
D | 向2支盛有2mL相同濃度硝酸銀溶液的試管中,分別加入2滴相同濃度的NaCl和NaI溶液 | 一支無明顯現象,另一支產生黃色沉淀 | 相同條件下,AgI比AgCl的溶解度大 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com