
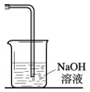
 實驗室常用以下方法制取氯氣:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答
實驗室常用以下方法制取氯氣:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答分析 (1)氯氣溶于水,部分與水反應生成鹽酸和次氯酸,鹽酸具有酸性,次氯酸具有漂白性,生成鹽酸溶液先變紅,次氯酸具有漂白性溶液退色;
;
(2)根據MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O計算;
(3)根據氯氣和氫氧化鈉反應的方程式求得所需氫氧化鈉的體積.
解答 解:(1)氯氣溶于水,部分與水反應生成鹽酸和次氯酸,鹽酸具有酸性,次氯酸具有漂白性,化學方程式:Cl2+H2O?HCl+HClO,生成鹽酸溶液先變紅,次氯酸具有漂白性溶液后退色,所以看到溶液先變紅后退色;
故答案為:溶液先變紅后退色;Cl2+H2O?HCl+HClO,生成鹽酸溶液先變紅,次氯酸具有漂白性溶液退色;
(2)因為MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,設參加反應的MnO2的質量為xg
87g 22.4L
xg 11.2L
所以x=$\frac{87g×11.2L}{22.4L}$=43.5g,答:參加反應的MnO2的質量為43.5g;
(3)4分鐘時n(Cl2)=$\frac{1.12L}{22.4L/mol}$×4=0.2mol,根據反應方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,需要n(NaOH)=0.4mol,所以V(NaOH)=$\frac{0.4mol}{2mol/L}$=0.2L=200mL,
答:NaOH溶液的體積至少應為200mL.
點評 本題通過對HClO的漂白性的探究,考查學生靈活運用知識的能力和嚴密的化學邏輯思維能力及相關基本計算能力,題目難度雖然不大,但也具有一定的綜合性,在答題時要注意規范的語言表達.


科目:高中化學 來源: 題型:解答題
 節能減排是當下環境保護的重點.
節能減排是當下環境保護的重點.| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器編號 | c(CO)/mol•L-1 | c(02)/mol•L-1 | c(C02)/mol•L-1 | V(正)和v(逆)比較 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | V(正)=v(逆 |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | V(正)> v(逆 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
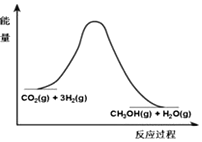 由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引用了各界的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),該反應的能量變化如圖所示:
由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引用了各界的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),該反應的能量變化如圖所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 陽離子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 陰離子 | NO3- CO32- SiO32- SO42- OH- |
| 序號 | 實驗內容 | 實驗結果 |
| Ⅰ | 向該溶液中加入足量稀鹽酸 | 產生白色沉淀并放出標準狀況下1.12L氣體 |
| Ⅱ | 將Ⅰ的反應混合液過濾,對沉淀洗滌、灼燒至恒重,稱量所得固體質量 | 固體質量為4.8g |
| Ⅲ | 向Ⅱ的濾液中滴加BaCl2溶液 | 無明顯現象 |
| 陰離子 | 濃度c/(mol•L-1) |
| ①CO32- | 0.5mol/L |
| ②SiO32- | 0.8mol/L |
| ③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯是無色帶有特殊氣味的液體 | |
| B. | 常溫下苯是一種不溶于水且密度小于水的液體 | |
| C. | 苯在一定條件下能與溴發生取代反應 | |
| D. | 苯不具有典型的雙鍵所應具有的發生加成反應的特性,故不可能發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com